Klinisk kemi – Sammanfattning
Detta är en sammanfattning av Kristoffer Carlsson (VT15). Modifierad av Elliot Soomro (VT21).
- Levern
- GI-kanalen
- Njurar och urinvägar
- Manliga genitalia
- Hypofysen
- Thyreoidea
- Binjurar
- Skelett
- Gonader
- Alkoholmarkörer
- Tumörmarkörer
- Carcinoembryonalt antigen (CEA)
- Cancerassocierat antigen 19-9 (CA19-9)
- Cytokeratin
- Cancerassocierat antigen 15-5 (CA15-3)
- Cancerassocierat antigen 125 (CA125)
- Humant epididymisprotein 4 (HE4)
- Squamous cell carcinoma antigen (SCCA)
- Humant koriongonadotropin (hCG)
- ∂-fetoprotein (AFP)
- Prostata-specifikt antigen (PSA)
- Neuronspecifikt enolas (NSE)
- Progastrin-releasing peptide (ProGRP)
- S100-ß
- Kromogranin A (CgA)
- Kalcitonin (CT)
- Thyreoglobulin (TG)
- Lysozym
- Tymidinkinas (TK)
- Monoklonala antikroppar
Levern
Leverns funktionella enhet kallas lobulus. Arteriellt blod och portablod i periferin flödar längs sinusoiderna in mot centralvenen, medan galla och lymfa flödar i motsatt riktning mot portazonerna. Sinusoiderna täcks av endotel och Kupfferceller (vävnadsspecifika makrofager). Detta nätverk släpper igenom proteiner och LDL men inte VLDL, kylomikroner eller celler. Skillnaden mellan cellerna i det periportala området (närmast portazonen), och de centrilobulära (närmast centralvenen) är att de förra deltar i proteinsyntes och glukoneogenes, och de sistnämnda i glykolys, lipolys samt biotransformation. Denna arkitektur förklarar också vissa sjukdomsprocesser. Virus som når levern via blodet skadar de periportala hepatocyterna först, medan hypoxi främst drabbar de centrilobulära cellerna, som ju får minst syrgas.
Leverns roll i energiomsättning, proteinsyntes och biotransformation:
- Lagrar stora mängder glykogen. Vid god tillgång, i närvaro av insulin, byggs depåerna upp.
- Syntetiserar fettsyror från Acetyl-CoA → Triglycerider → VLDL → blodbanan
- Vid svält och diabetes bryts leverns glykogen ned till glukos för energiförsörjning av t.ex. CNS. Levern syntetiserar även eget glukos genom t.ex. glukoneogenes.
- Levern kan syntetisera ketonkroppar som kan passera blod-hjärn-barriären.
- Reglerar det kolloidosmotiska trycket i plasma genom syntes av plasmaproteiner som t.ex. albumin.
- Tar hand om endogena (bilirubin, hormoner), samt exogena (läkemedel) substanser genom oxidering/hydroxylering/konjugering. Detta ger vattenlösliga och mindre toxiska substanser som kan utsöndras via urin eller galla.
- Lagrar spårämnen och transportproteiner som Transkobalamin, B12, riboflavin, folsyra och Vitamin A (i stellatceller), zink, koppar och järn.
Bilirubin
Referensintervall: Vuxna (totalt bilirubin) ‹ 25 μmol/L, (konjugerat bilirubin) ‹ 4 μmol/L
Ca 500 mmol bildas per dag vid nedbrytning av hemoglobin samt i mindre utsräckning myoglobin, cytokromer och peroxidaser. Enzymet hemoxygenas avlägsnar järnatomen från hemgruppen vilket bildar biliverdin som sedan reduceras till olösligt bilirubin, som transporteras bundet till albumin till levern. I det endoplasmatiska retiklet konjugeras bilirubinet med glukuronsyra och utsöndras sedan via gallan till tarmen. Väl i tarmen reduceras det konjugerade bilirubinet till urobilinogen som sedan oxideras till urobiliner och sterkobiliner, som ger feces dess normala bruna färg. Det finns en viss mängd fritt konjugerat bilirubin i plasma som filtreras i primärurinen vilket ger mörkfärgad urin. Vid t.ex. långvarig kolestas blir majoriteten av bilirubinet kovalent bundet till albumin, vilket orsakar mycket långsam regress av ikterus.
En ärftlig mutation i enzymet UDP-glukuronosyltransferas 1A (UGT1A1), förekommer hos 5-7% av befolkningen och orsakar Gilbert’s syndrom (juvenil ikterus). Hos dessa individer kan okonjugerat bilirubin i serum stiga till ›50μmol/L vid svält, feber eller motion. Hos nyfödda med vissa varianter av UGT1A1 stiger okonjugerat bilirubin under de första levnadsdygnen, eftersom leverfunktionen inte är fullt utvecklad. Om nivåerna stiger över 200 μmol/L, föreligger risk för s.k. kärnikterus, som kan ge upphov till svåra neurologiska rubbningar.
Vid mätning av bilirubin tas 5mL plasma eller serum, varpå centrifugerat prov förvaras i mörker (p.g.a. ljuskänslighet). På spädbarn kan kapillärprov användas. Kvinnor har 10 % lägre medelvärde än män, och dygnsvariation föreligger med nedgång till ca hälften på eftermiddagen.
Ett förhöjt totalbilirubin innebär antingen lever/gallvägspåverkan eller ökad erytrocytdestruktion. Vid lever/gallvägspåverkan ses även ett förhöjt konjugerat bilirubin. Om konjugerat bilirubin är förhöjt medan totalbilirubin är normalt, kan det vara tecken på lätt levercellsskada eller lätt gallstas (som t.ex. i efterförloppet till hepatit). Förhöjt totalbilirubin med lägre konjugeringsgrad innebär antingen ökad produktion av bilirubin (hemolytisk anemi, polycytemia vera, inre blödning), eller försämrad eliminationshastighet (Gilbert ́s syndrom).
Aminotransferaser (ALAT/ASAT)
Detta är en grupp av enzymer som katalyserar överförandet av en aminogrupp från en aminosyra till en ketosyra, varpå den senare blir en aminosyra och den förra en ketosyra. ALAT finns i cytoplasma i framförallt hepatocyter, men i viss mån även i njurarna, medan ASAT finns i såväl mitokondrier som i cytoplasman och förekommer i hög koncentration i hjärta, lever och skelettmuskulatur. ASAT/ALAT-kvoten i levern är 1,5-2,0 (ca dubbelt så mycket ASAT). Vid cellskador i levern läcker ASAT och ALAT ut ur hepatocyterna via sinusoider och lymfvägar. Vid akut toxisk leverskada, t.ex. överdosering av paracetamol, stiger aminotransferaserna snabbt till höga värden. Liknande akuta och snabbt övergående stegringar kan ses vid akut hypoxi orsakad av t.ex. chock, lungemboli eller allvarlig hjärtsvikt. Man bör ha i åtanke att även rubbningar i thyreoideafunktion och glukos/fett-metabolismen kan ligga bakom aminostransferasstegringar.
Anledningen till att ALAT stiger mer än ASAT vid parenkymskada, trots att det finns dubbelt så mycket ASAT i levercellen, är att ALAT är Litet, Löst i cytoplasma och har Längre halveringstid.
Tabellen nedan illustrerar viktiga skillnader mellan ALAT och ASAT:
| Alaninaminotransferas (ALAT) | Aspartataminotransferas (ASAT) |
| I cytoplasma i hepatocyter och njurar | I mitokondrier och cytoplasma i hjärta, lever och skelettmuskulatur |
| Används vid screening av levercellsskada | Bedömning av fibros/cirros hos pat. med kronisk leverskada |
| Värdet stiger inte av hemolys i provröret | Värdet stiger av hemolys i provröret |
| Kvinnor: ‹ 0,75 μkat/L, Män: ‹ 1,10 μkat/L* | Kvinnor: ‹ 0,60 μkat/L, Män: ‹ 0,75 μkat/L |
| Stiger mer än ASAT vid leverparenkymskada | Stiger mer än ALAT vid hjärtsvikt, skelettmuskelskada och hemolys |
| Högst specificitet | Stiger oftast mer än ALAT vid kronisk alkoholism |
| Stiger i den preikteriska fasen vid virushepatit |
Laktatdehydrogenas (LD)
Referensintervall (P/S):
Barn upp till 15 år: 2,0-5,0 μkat/L
Vuxna mellan 18-69 år: 1,8-3,4 μkat/L
Vuxna › 70 år: 1,9-4,3 μkat/L.
Finns i cytoplasman i alla kroppens celler. Enzymet katalyserar omvandlingen av L-laktat till pyruvat. Vid alla patologiska förändringar som ökar cellmembranets permeabilitet, ökar LD-halten i blodet. S-LD är alltså en ospecifik indikator på vävnadsskada. Test av LD är indicerat vid oklar aminotransferasstegring, vid hemolys/ineffektiv erytropoes samt som ospecifik markör vid malignitet och oklara muskelsjukdomar. Vid oklara muskelsjukdomar kan även laktatdehydrogenas-isoenzym 1-5 mätas. Vid hepatocellulär skada ökar LD tillsammans med aminotransferaserna.
γ-glutamyltransferas (GT)
Referensintervall (P/S):
Kvinnor ‹ 0,80 μkat/L
Män ‹ 1,30 μkat/L
Katalyserar överföring av glutamylgrupper från peptider till aminosyror. GT syntetiseras förutom i levern i t.ex. njure, prostata, pankreas och testiklar. Vid vävnadsskada ökar enzymhalten i respektive sekret (galla, urin, seminalvätska). Såväl GT som alkaliska fosfataser (nedan) visar lindriga stegringar vid hepatocellulär skada, och mer uttalade stegringar vid gallstas. Medan alkaliska fosfataser fungerar som akutfasreaktanter vid inflammation i gallvägar, stiger GT vid t.ex. steatos (fettlever) och gallstas, men även vid blodstas sekundär till högersvikt samt vid kronisk leverfibros- och cirros. GT-aktivitet induceras starkt av läkemedel (t.ex. benzodiazepiner och antiepileptika) samt av alkohol. GT-värden stiger med åldern upp till 50 år, och män har generellt högre nivåer. Diabetiker och överviktiga kan också ha höga GT- värden. GT-prov är indicerat vid leverutredning och för bedömning av leverpåverkan vid hyperlipemi och diabetes mellitus, samt vid malignitetsutredningar. P.g.a. låg sensitivitet och specificitet har analysen ersatts med CDT och PEth vid misstanke om alkoholmissbruk.
Alkaliska fosfataser (ALP)
Referensintervall ytterst metodberoende
Enzymer som hydrolyserar fosforsyraestrar. ALP innefattar en familj av membranassocierade enzymer som förekommer i placenta, lungor, tunntarmens brush border, njurtubulis mikrovilli, gallgångsepitel och i osteoblaster. ALP-aktivitet hos vuxna sker främst i gallgångsepitelet medan det hos barn sker främst i osteoblaster. Avflödeshinder i gallvägsträdet leder till ökad fosfatashalt i plasma (stas inducerar syntes av fosfataser). Andra orsaker till ökade nivåer av ALP är ökad osteoblastaktivitet samt vissa tarmsjukdomar. Höga värden (upp mot 160 μkat/L) förekommer, förutom vid gallvägsobstruktion, vid Pagets disease, avancerad rakit och skelettmetastaser med hög osteoblastaktivitet. Vid hyperparathyreoidism kan värden överstiga 50 μkat/L. Mindre stegringar, upp mot 15 μkat/L, ses vid osteomalaci, frakturer i läkning samt vid osteosarkom. Vid akuta levercellsskador ligger ALP-värdena de första dygnen inom det övre referensområdet för att sedan stiga till klart förhöjd nivå, dock vanligen under 10 μkat/L. Kronisk hepatit och levercirros ger klart förhöjda, respektive lätt förhöjda värden. Testning av ALP är indicerat vid screening och diagnostik av leversjukdomar samt vid misstanke på levermetastaser eller skelettsjukdom med ökad osteoblastaktivitet. Om ALP är den enda levermarkören som är förhöjd rör det sig sannolikt om skelettsjukdom.
Galaktosbelastning
Hos fastande normalpersoner förekommer galaktos varken i blod eller urin. Galaktos som intas via födan elimineras genom enzymatisk omvandling till glukos. Detta sker normalt till 70 % i levern via fosforylering. Minskad leverparenkymmassa avspeglas i långsammare galaktoselimination. Galaktosbelastning ger ett kvantitativt mått på den fungerande levercellsmassan. Testet görs genom att injicera 350 mg galaktos per kg kroppsvikt på en fastande patient. Sedan tar man med 10 minuters intervall kapillärt blodprov för att bestämma koncentrationen. Sedan räknas halveringstiden ut. Normal halveringstid hos friska vuxna är 7-17 minuter, och något kortare hos barn.
Plasmaproteiner vid leversjukdom
Immunoglobuliner, antitrypsin, orosomukoid, haptoglobin, transferrin, albumin
Eftersom plasmaproteinerna nästan uteslutande syntetiseras i levern, ger patologiska processer där upphov till förändringar i plasmaproteinernas proteinsammansättning. Eftersom levern har kraftig reservkapacitet märks generella sänkningar först när ca 80 % av parenkymet är utslaget.
- Antitrypsin stiger i koncentration proportionellt till graden av inflammation.
- Orosomukoid är oftast oförändrad medan haptoglobin oftast är sänkt. Sammantaget bildar dessa förändringar ett karakteristiskt mönster, så kallad leverlinje, som påträffas vid virushepatit, primiär biliär cirros, kronisk hepatit samt ospecifikt vid hemolys. Akuta inflammatoriska tillstånd i levern kan ge höga halter av leversyntetiserade proteiner för att sedan sjunka i proportion till minskande funktionell hepatocytmassa.
- Låg koncentration av albumin hos en kroniskt leversjuk patient tyder på kraftigt reducerad leverparenkymmassa.
- Selektivt låg koncentration av transferrin kan orsakas av hemokromatos.
- Immunoglobuliner varierar i koncentrationen på ett karakteristiskt sätt vid leversjukdomar. Virushepatiter ger först höga nivåer IgM och senare ökar IgG. Högt IgG förekommer även vid autoimmun kronisk hepatit medan isolerat högt IgM är typiskt för primär biliär cirros. IgA-stegringen vid alkoholbetingad leverskada och vid kolestas beror sannolikt på en defekt IgA-transport över hepatocyten.
Övrigt
Vid normal tillgång till vitamin K anses en stigande PK-INR vara en bättre indikator på krympande hepatocytmassa än serumalbuminnivån. Inför en eventuell leverbiopsi eller andra ingrepp på en leversjuk patient ska ett enkelt koagulationsstatus (PK-INR, P-APT-tid, B-trombocyter och Pt-blödningstid) utföras.
GI-kanalen
Gastrin
Referensintervall (vid fasta): ‹ 50pmol/L
Peptidhormon som insöndras från G-celler i ventrikelns antrumdel. Frisätts vid vagusstimulering och genom dilatation av antrum vid intag av föda. Hyperkalcemi och pH-förhöjning ger också gastrinfrisättning. Gastrin stimulerar sekretion av magsaft och påverkar även pankreas, gallflödet, motilitet samt absorption av elektrolyter och vatten genom tarmslemhinnan. Patienter med atrofisk gastrit har oftast höga koncentrationer gastrin i plasma, samtidigt som pepsinogen-A är sänkt. Gastrinproducerande tumörer i pankreas (gastrinom) är ibland förenade med kraftig förhöjda gastrin- och pepsinogennivåer tillsammans med recidiverande svåra multipla duodenalulcerationer (Zollinger-Ellisons syndrom).
Bestämning av gastrinkoncentration är indicerat vid:
- Misstanke på Zollinger-Ellisons syndrom (recidiverande duodenalulcerationer)
- Misstanke på atrofisk gastrit (t.ex. vid utredning av kobalaminbrist och/eller järnbrist)
- Allvarlig refluxesofagit, speciellt i samband med diarré
- Misstanke på multipel endokrin neoplasi typ 1 (MEN1)
Hypergastrinemi kan även ses vid:
- perniciös anemi med påföljande upphävd syrasekretion
- långvarigt bruk av protonpumpshämmare
- H. Pylori-infektion i antrumslemhinnan.
Sekretin
Referensintervall (vid fasta): ‹ 4 pmol/L
Basisk polypeptid som återfinns i S-celler i f.f.a. distala duodenum och jejunum. Dess främsta fysiologiska effekt anses vara att stimulera sekretion av galla och gallblåsetömning, samt sekretion av bikarbonat från pankreas. Nivåerna är förhöjda vid fasta hos patienter med Zollinger-Ellisons syndrom, förhöjda vid njurinsufficiens samt låga (trots födointag) hos patienter med celiaki.
Vasoactive intestinal peptide (VIP)
Referensintervall: ‹ 20 pmol/L
Finns i nervfibrer i GI, lungor, pankreas, CNS samt urogenitalia. Stimulerar frisättning av prolaktin och oxytocin från hypofys/hypothalamus, samt sekretion av pankreassafter. Är antagonist till gastrin och inhiberar saltsyrasekretion. Reglerar sannolikt GI-kanalens blodflöde, muskelaktivitet och epitelfunktion samt har betydelse för erektionsförmågan.
Vissa tumörer, såsom insulinom i pankreas, neuroblastom, feokromocytom, medullär tyreoideacancer och bronkialcancer kan producera VIP, som i sin tur kan orsaka allvarlig diarré som ett paraneoplastiskt symptom. En VIP- koncentration › 60pmol/L stödjer misstanke om VIP-producerande tumör. Måttligt förhöjda VIP-koncentrationer har beskrivits vid blödningschock samt hos patienter med grav levercirros. Test av VIP-koncentration är indicerat vid tillstånd med kraftig vattnig diarré med hypokalemi i kombination med misstanke på tumör i pankreas, tyreoidea eller lungor.
Biomarkörer för gastrit och atrofisk gastrit
Diagnoserna gastrit och atrofisk gastrit baseras på endoskopisk bedömning av magslemhinnans morfologi. Selektion av individer för gastroskopi och biopsiprovtagning kan ske på basen av resultat från mätning av dessa biomarkörer:
- Antikroppar mot H. pylori. H. pylori-infektion kan påvisas genom mätning av IgG, utandningsundersökning (se urea breath test), undersökning av antigen i feces o.s.v.
- Antikroppar mot H/K-ATPas. Detta är ett membranenzym i parietalcellerna, som uttrycks kraftigt både vid autoimmun- och H. pylori-orsakad gastrit.
- Antikroppar mot intrinsic factor. Dessa förekommer i serum och magsaft vid kronisk atrofisk gastrit typ A och vid perniciös anemi.
- Pepsinogen A. Bildas i fundus-korpus. Läcker ut vid inflammation i slemhinnan.
- Pepsinogen C. Bildas i antrum. Vid antrumgastrit föreligger hög serumkoncentration av Pepsinogen C.
Celiaki
Diagnosen ställs av tradition genom histologisk undersökning av tunntarmsbiopsi tagen medan patienten fortfarande använder glutenhaltig kost. Förstahandsundersökning numera är dock mätning i plasma av IgA-antikroppar mot transglutaminas 2. Hos patienter med IgA-brist bör man även mäta IgG mot transglutaminas 2. Vid misstänkt falskt positiva mätvärden kan påvisande av HLA-DQ2/8 vara av värde. Avsaknad av dessa talar starkt emot diagnosen. Allmänt så bör diagnostiken ske på vida indikationer med tanke på den ospecifika symtomatologin och de ibland svåra konsekvenserna av celiaki. Riktad screening bör ske för släktingar till konstaterade fall, patienter med kronisk diarré, IBD/IBS, autoimmun sjukdom, järn/B12-brist, kronisk trötthet, infertilitet, epilepsi eller osteoporos.
Antikroppsmätningar vid celiaki:
- IgA- och/eller IgG mot transglutaminas 2. Man använder antigen från marsvin eller människa och tar sedan serum/plasma från patienten och analyserar antikroppar med ligandanalysmetoder eller immunofluorescens + mikroskopi.
- IgA mot endomysium. Som antigen använder man snitt från esofagus från apa eller human navelsträng. Provet från patienten är serum eller plasma. Sedan granskar man fluorescensfärgningsmönstret i mikroskop. Denna metod är användbar vid oklara fall.
- IgA- och/eller IgG mot gliadin. Denna metod användes tidigare men har nu ersatts av endomysieantikroppar p.g.a. högre sens./spec.
Patienter med autoimmun sjukdom, men utan celiaki, kan visa falskt positiva mätvärden vid dessa antikroppsmätningar. Det föreligger också risk för falskt negativa resultat, främst hos de som valt bort glutenhaltiga födoämnen ur kosten. Diagnosen celiaki kräver därför en noggrann diagnostisk utredning, eventuellt inkluderande glutenprovokation.
Utredningsgång för diagnosticerande av celiaki:
- Analys av IgA (+ ev. IgG) mot TG2 (+ ev. endomysium)
- Mätning av HLA-DQ2/8 vid misstanke på falskt positivt mätresultat av AK.
- Endoskopisk undersökning och tunntarmsbiopsi med fastställande av histologisk gradering enligt Marsh-skala; Normal slemhinna (Marsh 0), Infiltrativ (Marsh 1), Hyperplastisk (Marsh 2), Villusatrofi (Marsh 3), Hypoplastisk slemhinna (Marsh 4).
Övriga utredningar som bör göras är:
- Anemiutredning till följd av brist på järn, folater, kobalaminer.
- Hemostasutredning till följd av vitamin K-brist.
- Utredning för brist på zink och koppar.
- Utredning för andra autoimmuna sjukdomar (främst autoimmun tyreoideasjukdom, diabetes mellitus typ 1, Addisons och leversjukdom).
Behandling sker genom uteslutande av gluten från kosten, samt eventuell behandling av övriga bristtillstånd/komplikationer.
Laktosintolerans
Laktos är en disackarid som spjälkas av laktas i mukosacellernas brush border till glukos och galaktos som sedan absorberas. Laktos som inte spjälkas jäser genom påverkan av bakterier i tarmen vilket leder till flatulens, diarré och buksmärtor.
Primär laktosintolerans innebär en selektiv laktasbrist, och ger symtom antingen tidigt i barnaåren eller först i vuxen ålder.
Sekundär laktosintolerans kan uppträda I samband med generell skada på tarmepitelet t.ex. vid celiaki, gastroenterit och vid cytostatika/strålbehandling.
Ytterliggare finns den betydligt allvarligare formen medfödd laktosintolerans, som innebär medfödd brist på laktas som ger sig till känna vid första laktosintaget.
Diagnostisering sker med hjälp av laktosbelastning, gentest, andningstest eller mätning av laktasaktivitet i biopsier.
- Laktosbelastning. Patienten ska vara fastande sedan föregående kväll och ha stått på mjölkfri kost sedan tre dagar. Patienten får sedan dricka en laktoslösning med 1g laktos/kg kroppsvikt. Prov för bestämning av blodglukos tas före och med 15 minuters intervall under en timme efter laktostillförsel. Efter provtagning tas även urinprov som prövas på förekomst av laktos och glukos. Efter laktostillförseln bör glukoshalten i blodet stiga minst 1,3mmol/L. Stegring under detta tyder på laktosintolerans. Laktosuri förekommer inte alltid men bekräftar diagnosen. Man kan också mäta vätgasstegring i utandningsluften. Observera att vid kliniskt klara fall är laktosbelastning kontraindicerat då det kan ge avsevärda besvär för patienten.
- Gentest. Ger genetiskt specifikt svar men inte funktionellt specifikt eftersom man inte kan påvisa sekundär laktosintolerans. Man extraherar DNA ur leukocyter och påvisar DNA-polymorfier i LCT-13910-genen med hjälp av PCR. Heterozygota anlagsbärare kan ha lättare laktosintolerans medan homozygota anlagsbärare har det jobbigare.
Urea – utandningstest
Växt av H. Pylori i övre delen av GI är mycket vanlig hos patienter med ulcus-gastritsjukdom, samt predisponerar för cancer. Bakterien bildar stora mängder av enzymet ureas, som spjälkar urea i koldioxid och ammoniak. Växt av H. Pylori kan antingen beläggas genom att påvisa spjälkning i biopsiprov, eller genom att följa metabolismen av peroralt intaget C-urea genom analys av CO2 i utandningsluften. Sensitivitet och specificitet för den senare metoden är › 95 %. Falskt negativa resultat kan ses efter antibiotikakurer på annan indikation än H. Pylori. Undersökningen bör endast göras vid riktad misstanke eftersom ca 20 % är symtomfria bärare av bakterien.
Amylas
Referensintervall: 0,31-0,79 μkat/L
Produceras i GI-kanalens spottkörtlar samt i pankreas, och har som funktion att spjälka stärkelse och glykogen. Amylasaktiviteten stiger vid akut pankreas- och spottkörtelpåverkan, samt vid njurinsufficiens. Sänkt amylasaktivitet ses vid pankreasinsufficiens som vid kronisk pankreatit och cystisk fibros. Förhöjd aktivitet ses under de 3-5 första dygnen vid akut pankreatit varefter värdena normaliseras. Förhöjd aktivitet kan även iakttas hos patienter med perforerande ulcus eller med ileus. Makroamylasemi innebär att amylas komplexbinder till något plasmaprotein (vanligen IgA). Detta kan ge kraftigt höjda amylasnivåer, trots att patienten är frisk. Amylastest är främst indicerat vid oklara akuta bukfall.
Kalprotektin
Referensintervall: Barn › 4 år och vuxna: ‹ 50 mg/kg. Barn under 1 år: Betydligt högre koncentrationer
Kalcium- och zinkbindande protein som förekommer i hög koncentration i neutrofila granulocyter. Kalprotektin har hämmande effekter på tillväxt av både bakterier och svampar, samt är proteasresistent vilket gör det stabilt i GI-kanalen och vid provförvaring. Koncentrationen kalprotektin är således proportionellt till antalet neutrofiler i mag-tarmkanalens lumen. Kraftigt förhöjda koncentrationer förekommer vid inflammatoriska tarmsjukdomar som Mb Crohns och Ulcerös kolit. Mindre förhöjda koncentrationer kan även ses vid celiaki, kolorektal cancer, bakteriell gastroenterit och divertikulos.
Koncentrationen av kalprotektin i avföringen hos vuxna är normalt mycket låg. Mätningen har högt negativt prediktivt värde vilket innebär att normal koncentration med mycket hög sannolikhet utesluter inflammatorisk tarmsjukdom. Mätning är indicerat främst vid misstanke på inflammatorisk tarmsjukdom. Mätningen sker i feces. Övriga liknande proteiner som kan mätas vid misstanke på Crohns eller ulcerös kolit, men som har något lägre sensitivitet och specificitet är myeloperoxidas och laktoferrin.
Triloeintest
Görs vid misstanke på steatorré (fett i feces). Man studerar tarmkanalens förmåga att absorbera en radioaktivt märkt triglycerid (C-triloein). Patienten dricker en fettrik vätska med C-triloein som spjälkas, absorberas och metaboliseras. CO2 i utandningsluften samlas efter 2, 4, 5, och 6 timmar. Triloeintest är indicerat vid utredning av malabsorptionstillstånd.
Njurar och urinvägar
Clearance
Den hastighet med vilken en substans elimineras från en kroppsvätska, t.ex. blodet, är beroende av två faktorer: funktionen av det organ som står för eliminationen (t.ex. njurarna), samt den aktuella koncentrationen i kroppsvätskan av substansen som elimineras. Clearance är alltså en allmän term som används för att kvantitativt beteckna hur snabbt en substans elimineras från kroppen, i regel från blodbanan. Med plasmaclearance avses elimination från blodbanan oavsett vilken väg det sker, medan man med renal, hepatisk clearance etc. avser den elimination som sker via organet i fråga. Om en substans endast elimineras via ett organ är alltså plasmaclearance och organclearance lika. Om eliminering bara sker via glomerulär filtration är clearance = GFR. Steady state innebär att man utsöndrar lika mycket som man tar in av ett ämne, t.ex. läkemedel.
Nivådiagnostik
Njursjukdomar kan påvisas och lokaliseras inom nefronet genom relativt enkla analyser (se tabell nedan). Glomerulära sjukdomar kan bedömas utifrån GFR och glomerulär permeabilitet. P-Cystatin C och P-Kreatinin är i första hand avsedda för screening av njurarnas funktionella tillstånd (GFR), medan urinproteinmönstret tillåter en bedömning av det glomerulära filtrets täthet för proteiner. Urinsediment avslöjar bl.a. blodkroppar och cylindrar i urin, vilket kan vara tecken på glomerulär sjukdom eller andra sjukdomar i urinvägarna. Observera att värden inom normala referensgränser inte garanterar att båda njurarna fungerar som de ska, eftersom de har en kraftig reservkapacitet. Vid graviditet till exempel, så ökar GFR för småmolekyler, eftersom fler arterioli är öppna, vilket ger sänkning av P-Kreatinin.
| Glomerulär sjukdom | Tubulär sjukdom | |
| Kliniska tecken | Hypertoni, ödem, uremi | Intorkning, polyuri |
| Urinanalys | Albuminuri, U-sediment: korniga cylindrar, vaxcylindrar, fragmenterade RBC | U-Osmolalitet sänkt, U-pH förhöjt, U-Protein HC förhöjt |
| Blodprov | Förhöjt P-Cystatin C och P-Kreatinin, acidos, hyperkalemi | Acidos, hyperkalemi |
Hematuri
Makroskopisk hematuri ses som en brunröd missfärgning av urinen redan vid en tillblandning av 1mL blod till 1L urin och kan verifieras genom testremsa. Makro-hematuri har hög klinisk signifikans, och bör alltid utredas, eftersom den nästan alltid är förenad med sjukdomstillstånd (1/3 sten, 1/3 tumör, 1/3 inflammation). Vid mikroskopisk hematuri krävs kemisk diagnostik med hjälp av testremsa, som till skillnad från mikroskopi av urinsediment, ger utslag för såväl ökat antal erytrocyter som för fritt Hb och myoglobin. Mikroskopisk hematuri är vanligt efter fysisk ansträngning, och prevalensen för allvarliga sjukdomar är mycket låg i denna grupp. Provtagningen sker med mittportionsurin.
Bakterieuri
Signifikant bakterieuri (› 10^8/L urin) innebär att bakterier förökar sig inom urinvägarna ovan uretra. Förutom urinodling kan förekomst av nitrit användas för att påvisa bakterieuri. Vid nitrittestet utnyttjar man bakteriernas förmåga att reducera nitrat till nitrit. Det krävs att urinen inkuberas i minst 4 timmar i blåsan för att testet skall vara giltigt. Sedan analyseras mängden nitrit i urinen. Falskt negativa resultat kan fås om patientens kost inte innehåller tillräckligt med nitrat (finns i grönsaker), eller om bakterien saknar nitritreduktas (vissa enterokocker och stafylokocker). Sensitiviteten för testet är vid optimala förhållanden omkring 80-90 %.
Leukocyturi
Referensintervall: ‹ 10-20 x 10^6/L
Förhöjt antal leukocyter i urinen är ett kardinaltecken på njurinflammation eller urinvägsinfektion. De vanligaste cellerna är neutrofila granulocyter. Leukocyturi utan bakterieuri kan ses vid antibakteriell behandling av UVI, vid kronisk pyelonefrit och andra former av interstitiell nefrit, samt vid glomerulonefrit, tuberkulos, virusinfektion och tumörer. Provtagning för testremsan sker med mittportionsurin. Test av leukocyturi är indicerat vid diagnostik av inflammation och infektion i njurar och urinvägar.
Urinsediment
Som sediment betecknas den massa som efter centrifugering av urin ansamlas på centrifugrörets botten. Makroskopiskt ses en röd zon i sedimentet vid uttalad hematuri, medan riklig förekomst av neutrofila leukocyter ger ett pusliknande utseende av sedimentet.
Mikroskopiskt kan man bl.a. urskilja:
- Leukocyter och erytrocyter
- Tubulusepitel, skivepitel och urotel
- Cylindrar
- Salter och kristaller
- Bakterier, svampar och spermier
Urinprovet bör vara mittportionen av morgonurin, men urin som stått i blåsan i minst 4 timmar fungerar. 10 mL urin centrifugeras i provrör. Sedimentet skakas upp, färgas och undersöks sedan på objektglas vid 100 och 400 gångers förstoring. Enstaka erytrocyter/leukocyter samt enstaka hyalina cylindrar per synfält är normalt. Förekomst av dysmorfa erytrocyter liksom cellcylindrar och/eller korniga cylindrar talar för njurparenkymskada. Ökat antal leukocyter, pyuri, är tecken på inflammation i urinvägarna. Urinsedimentundersökning är framförallt indicerat vid inflammatoriska njursjukdomar som exempelvis glomerulonefrit.
Cylindrar uppstår i njurarnas tubuli. De består huvudsakligen av proteiner som fällt ut, vilket normalt kan ske i starkt sur eller koncentrerad urin. Under patologiska förhållanden kan celler (röda, vita eller epitel) eller cellrester bakas in i cylindrarna. Ju bredare cylindrar, desto allvarligare skada (tyder på dåligt flöde i samlingsrören).
Typer av cylindrar:
- Hyalin cylinder (1). Består av mukoprotein som bildas i njurtubuli. Enstaka 1 finns normalt i urinen. Ökat antal kan ses efter kraftig ansträngning, eller efter period med hög feber. De tar upp färg dåligt, och är vanligen ofärgade eller ljusrosa, samt rundade i kanterna.
- Erytrocytcylinder (2). Tecken på glomerulär dysfunktion som vid t.ex. akut glomerulonefrit, SLE, RA och vaskulit.
- Leukocytcylinder (3). Förekommer vid pyelonefrit, samt ibland vid nefrotiskt syndrom samt vid interstitiell nefrit
- Njurtubulicylinder (4). Består av njurepitel. Kan ses vid akut tubulär nekros, samt vid förgiftning av t.ex. kvicksilver. Kan även förekomma vid nefrotiskt syndrom.
- Kornig cylinder (5). Bildas av cellrester eller proteinaggregat då dessa läcker ut vid filtration i glomeruli. De förekommer vid glomerulonefrit, samt ibland efter kraftig ansträngning eller period med hög feber.
- Vaxcylinder (6). Tyder alltid på grav njurskada (kronisk). Består av 3 lipoproteiner som läckt ut i urinen. Blir kraftigt infärgad, är bred och är ofta väldigt kantig. Har ofta små hack i kanten. Ses ofta hos uremipatienter och vid nefrotiskt syndrom.
Proteinuri
I normal urin utsöndras dagligen en viss mängd proteiner (t.ex. albumin upp till 42 mg/L, IgG upp till 8 mg/L, orosomukoid upp till 10 mg/L ). Det är därför viktigt att tänka på att begreppet ”ingen proteinuri” som används i klinisk praxis inte är att tolka bokstavligt. Det kapillära filtret i glomeruli består av endoteliala celler, ett kraftig basalmembran och epiteliala celler med ett negativt laddat polysackaridskikt på ytan. Det tillhör kroppens proteintätaste filter. Polysackaridbarriären bryts ned vid nefrotiskt syndrom, vilket förklarar den massiva albuminurin med tillhörande ödem och hyperlipidemi vid detta tillstånd.
Olika typer av proteinuri:
- Prerenal. Plasmakoncentrationen av filtrerbart protein överskrider den tubulära reabsorptionsförmågan. Exempel: Bence-Jones proteinuri, inflammatoriska processer som höjer orosomukoid kraftigt, samt vid hemolys där plasmas hemoglobinbindande kapacitet överskridits.
- Glomerulär. Mängden protein i ultrafiltratet ökar på grund av ökad glomerulär permeabilitet för plasmaproteiner (t.ex. vid glomerulonefrit, SLE, diabetes mellitus och amyloidos). Vid selektiv glomerulär proteinuri domineras bilden av albumin, orosomukoid och transferrin. Vid oselektiv glomerulär proteinuri tillkommer även IgG, och fördelningen blir mer lik den i plasma.
- Tubulär. Reabsorptionen av primärurinens mest lågmolekylära proteiner är nedsatt. De proteiner som dominerar är protein HC, cystatin C, retinolbindande protein (RBP), B2-mikroglobulin samt fria lätta Ig-kedjor. Tubulär proteinuri är ett tidigt symtom vid utvecklingen av tubulusskada vid metallförgiftningar, samt vid interstitiell nefrit.
- Hyperalbuminuri. En låggradig sådan sker vid s.k. ortostatisk proteinuri, som försvinner vid horisontalläge (morgonurinprov). Efter kroppsansträngning sker en viss ökning av albuminutsöndringen.
Analys av urinproteinmönster
Resultaten från urinhalter av albumin, IgG, protein HC, samt fria lätta kappa/lambda-kedjor tillåter oftast direkta slutsatser om glomerulära/tubulära skador. Proteinuri kan undersökas med urinstickor. Dessa är dock designade för att reagera på albumin i första hand, vilket gör att de kan vara opålitliga om man ska titta på andra proteinmönster.
Bedömning av proteinuri sker enligt följande:
- Ökad albumin och IgG = Skada på glomerulära barriären.
- Ökad albumin = Selektiv glomerulär proteinuri (minimala histopatologiska förändringar).
- Ökad halt protein HC = Tubulära njurskador, såvida inte uremi föreligger samtidigt.
- Ökad halt kappa/lamdba-kedjor = Bence-Jones proteinuri (som vid t.ex. multipelt myelom).
U-albumin, U-albumin-kreatinin-kvot
Referensintervall: Morgonurin ‹ 3 g albumin/mol kreatinin, övrig urin ‹ 5
Att bestämma albumin/kreatinin-kvot istället för albumin i urinen gör att man minimerar diuresens inflytande på bestämning av albumingrad. Albumin/kreatinin-kvot används för bedömning och behandling av vanliga sjukdomar som ateroskleros, hypertoni och diabetes mellitus. Urinutsöndringen av albumin, mätt som mg/mmol kreatinin, är alltid positivt korrelerad till såväl insjuknande som död i kardiovaskulär sjukdom. Låggradig hyperalbuminuri indikerar mikroangiopati. Vid diabetes, hypertoni och ateroskleros är en ökning av den låggradiga hyperalbuminurin den kanske viktigaste indikatorn på att behandlingen behöver intensifieras. Ändringar i den mer uttalade hyperalbuminurin vid akuta/subakuta glomerulära njursjukdomar avspeglar sjukdomsförloppet.
U-IgG
Referensintervall: ‹ 8 mg/L
Man testar IgG i urinen för att klassificera glomerulära njurskador som antingen selektiva eller oselektiva. Eftersom IgG är en större molekyl än albumin, är IgG i urinen ett tecken på oselektiv proteinuri, vilket har en sämre prognos än selektiv proteinuri.
GFR (Glomerulär filtrationshastighet)
Bör alltid anges som estimerat (eGFR) eller exakt uppmätt GFR, och inte indirekt via plasmakoncentrationen av en filtrationsmarkör, som exempelvis P-kreatinin eller P-cystatin C. För exakt bestämning av GFR krävs en invasiv clearancemetod, t.ex. iohexolclearance. Iohexol är ett vattenlösligt, icke-proteinbundet ämne som filtreras fritt i glomeruli och varken tas upp eller utsöndras i tubuli. Iohexol fungerar på så vis som en GFR-markör som injiceras, varpå plasmaeliminationen följs. Vid uttalad njurfunktionsnedsättning tar man ibland 24 timmars iohexol. Det beror på att plasmakoncentrationen av iohexol minskar långsamt hos dessa patienter, och längre undersökningstid behövs således för att erhålla en påtaglig koncentrationsminskning för att kunna bestämma GFR. I de flesta fall räcker det dock med att ange estimerat GFR (eGFR) som man fått genom att mäta Cystatin C/Kreatinin och justera för kön och ålder.
GFR korrigeras ofta i relation till kroppsyta och uttrycks då som ml/min x 1,73 kvm – ”standardiserat till genomsnittlig kroppsyta”. Det gör det lättare att upptäcka avvikelser. När den absoluta eliminationshastigheten efterfrågas, t.ex. vid dosering av läkemedel, ska korrigering för kroppsyta inte ske.
Läs mer om och beräkna eGFR på egfr.se.
P-Cystatin C
Referensintervall: ‹ 50 år = 0,50-1,10 mg/L, › 50 år = 0,70-1,25 mg/L
Utsöndras med konstant hastighet från alla kärnförande celler och förekommer i alla extracellulära rum. Cystatin C i plasma elimineras genom glomerulär filtration med ett clearance som är i stort sett lika som kreatinin och iohexol. Därpå reabsorberas och kataboliseras det i det närmaste fullständigt i proximala tubuli. Exkretion förekommer ej. Eftersom vare sig kön, muskelmassa eller inflammationsgrad signifikant påverkar produktionen av Cystatin C, kommer plasmahalten att avspegla GFR och är således ett bättre mått på denna än kreatinin. Cystatin C är dessutom lika för båda könen hos barn över ett år, vilket gör det till en bättre GFR-markör hos barn jämfört med kreatinin. Behandling med glukokortikoider ökar produktionen av Cystatin C, vilket gör att halten i plasma inte pålitligt återspeglar GFR i de fallen.
Cystatin C-prov är indicerat vid screening av njurfunktion (GFR) och är speciellt lämpligt för detta i det kreatininblinda området (mer om detta nedan), samt hos barn och äldre.
P-Kreatinin
Referensintervall: Män = 60-105 μmol/L, Kvinnor = 45-90 μmol/L
Kreatinin lagras som kreatinfosfat i muskler och frigörs vid muskelkontraktion. Plasmakreatinin härstammar främst från endogent kreatinin, men efter mycket köttrika måltider (f.f.a. kokt kött) absorberas så mycket kreatinin av plasmanivån kan stiga med upp till 65 %. Kreatinin filtreras i glomeruli och reabsorberas/exkreteras knappt, varför det ofta används för att uppskatta GFR. Då GFR avtar, ökar kreatininhalten i plasma. Vid normal njurfunktion är kreatininhalten i plasma beroende av om individen har en liten eller stor muskelmassa. Plasmakreatininet hos barn varierar kraftigt med åldern, varför den är svåranvänd som markör för GFR hos barn.
Det ”kreatininblinda området” är ett begrepp för den lätta till måttlig sänkning av GFR som kan föreligga trots ett kreatininvärde inom det aktuella referensområdet. GFR kan behöva sjunka med 60 % för att kreatininhalten ska vara säkert förhöjd.
Förhöjda värden av kreatinin ses ofta vid njurskador med minskad GFR, samt vid njursten. Värden inom det normala referensområdet utesluter inte lätt eller måttligt sänkt GFR, medan sänkningar av GFR vid kraftigt nedsatt njurfunktion avspeglas i tydliga förändringar av plasmakreatininhalten. Sänkta halter förekommer vid malnutrition, muskelatrofi (vid t.ex. RA, paralys och hög ålder), varvid plasmakreatininvärdet ger en falskt hög skattning av GFR. Sänkta värden ses även vid graviditet till följd av hyperfiltration.
Prov för P-kreatinin är indicerat vid screening av GFR. Upprepade bestämningar av kreatinin ger god information vad gäller förändringar i patientens GFR under ett sjukdomsförlopp.
S-Urea
Referensintervall 2,0-9,0 mmol/L
Urea bildas när kroppen bryter ner aminosyror. Det ammoniak som bildas omvandlas till urea via ureacykeln och utsöndras via urinen. Urea bildas i levern. S-urea påverkas av proteinintag och balansen mellan proteinsyntes och proteinnedbrytning. Eliminationen av urea ökar med ökade urinmängder och sjunker vid låg diures. Vid infektion och stess minskar proteinsyntesen -> ökade nivåer av urea. Ökade nivåer av kortisol ger också ökat S-urea.
Utsöndring av vätejoner
Normalt behöver njurarna eliminera ca 50 mmol vätejoner per dygn. En minskad förmåga att styra utsöndringen efter behovet leder till renal tubulär acidos. Tillståndet är genetiskt betingat och ger symptom redan under första levnadsmånaden i form av kräkningar och dålig viktökning. Acidosen leder till ökad urinutsöndring av fosfat, kalcium och kalium, vilket i vuxen ålder manifesteras som nefrokalcinos (förkalkning i nefronen), hyperparatyreoidism och hypokalemi. Tillståndet kan kompenseras med peroral substitution med bikarbonat. För att studera njurarnas förmåga att utsöndra vätejoner, gör man en syrabelastning med ammoniumklorid (salmiak).
Desmopressintest
Desmopressin är en syntetisk ADH-analog. Desmopressin påverkar njurcirkulation och permeabiliteten för vatten i samlingsrören så att återresorptionen blir maximal, d.v.s. urinosmolaliteten når ett för individen högsta värde. Desmopressin ges vanligen som subkutan injektion eller intranasalt med spray på en törstande patient. Inom en timme efter injektionen får patienten tömma blåsan, och efter 3-5 timmar får hen göra det igen. Av urinmängden skickas 5 mL till lab för beräkning av osmolaliteten. Nedsatt förmåga att koncentrera urinen vid normal ADH-aktivitet är ett känsligt men ospecifikt tecken på försämrad tubulusfunktion. Syndrom som orsakar detta är exempelvis renal diabetes insipidus, akut/kronisk pyelonefrit, samt alkalos, hypokalemi, hyperkalcemi, renal ischemi och uremi. Man skiljer på neurogen diabetes insipidus där det föreligger brist på ADH och renal diabetes insipidus som orsakas av ”fel” i njuren. Den vanligaste orsaken till renal diabetes insipidus är litiumbehandling (används t.ex. vid bipolaritet).
Bilddiagnostik vid njurundersökning
Man använder olika typer av bilddiagnostik beroende på vad man vill undersöka. Urografi är en vanlig slätröntgen/CT av njurarna. Här tittar man efter tumörer, obstruktioner i urinvägarna (t.ex. njursten) mm. Man kan även använda sk. tomosyntes som är som en blandning av slätröntgen och CT och därför ger lite djup.
För att undersöka njurarnas funktion används istället scintigrafi. Dynamisk scintigrafi kallas i dagligt tal för renografi och med dess hjälp undersöker man funktionsfördelning mellan njurarna och ev. avflödeshinder. Njurscintigrafi bygger på intravenös kontrast som undersöks med gammakamera. För att kartlägga njurarnas funktion kombinerar man vanligen renografi för sidofördelning och GFR för att undersöka den faktiska filtrationen.
Manliga genitalia
Prostataspecifikt antigen (PSA)
Referensintervall: ‹ 50 år: ‹2,0 μg/L, › 50 år: ‹3,0 μg/L, PSA-kvot (fritt/tot): ‹ 0,18
PSA är ett serinproteas som produceras i prostatas körtelepitel och utsöndras i höga halter till prostatasekretet. Testosteron och dihydrotestosteron stimulerar till PSA-produktion. PSAs funktion i sädesvätskan är att likvefiera (lösa upp) sädesvätskans gelproteiner, varpå rörliga spermier frisätts. Normalt förekommer PSA i låga halter i blodet (‹ 3 μg/L). Ökat läckage av PSA ut i blodbanan ses vid prostatacancer, benign prostatahyperplasi (BPH) samt vid bakteriell prostatit. I blodet förekommer PSA främst i komplex med andra proteiner (t.ex. a1-antikymotrypsin och a2- makroglobulin). PSA i komplex med a1-antikymotrypsin utgör 80-85 % av den totala halten. Dagens bestämningsmetoder detekterar PSA i komplex med det första exemplet. PSA förekommer även i blodet i en fri men inaktiv form, med en halveringstid på 1,5 timmar.
Vid prostatacancer kan den ökade halten PSA i serum sannolikt förklaras av den ökade cellmassan, vävnadsarkitekturen samt omsättningen (nekros) av maligna epitelceller i prostata/metastaser. Vid BPH sjunker andelen komplexbundet PSA till ca 70-80 %.
För att minska den preanalytiska variationen bör patienten ha suttit i 15 minuter föreprovtagningen. Rektalpalpation ger ingen kliniskt betydelsefull ökning av den totala PSA-halten i serum, men andelen fritt PSA stegras sannolikt kortvarigt.
Bedömning: BPH är den vanligaste orsaken till måttligt förhöjd totalhalt av PSA i plasma (3-10 μg/L). Vid dessa PSA- halter förekommer cancer hos enbart 20-25 % av de undersökta. Vid PSA-halt över 10 μg/L förekommer cancer hos mer än 50 %. Diagnosen prostatacancer fastställs cytopatologiskt i biopsi. Detekterbar och stigande koncentration av PSA i plasma efter kurativ behandling av prostatacancer tyder på recidiv eller disseminerad sjukdom (metastaser). PSA-halten i plasma ökar med åldern utan samtidig förekomst av prostatacancer.
Hypofysen
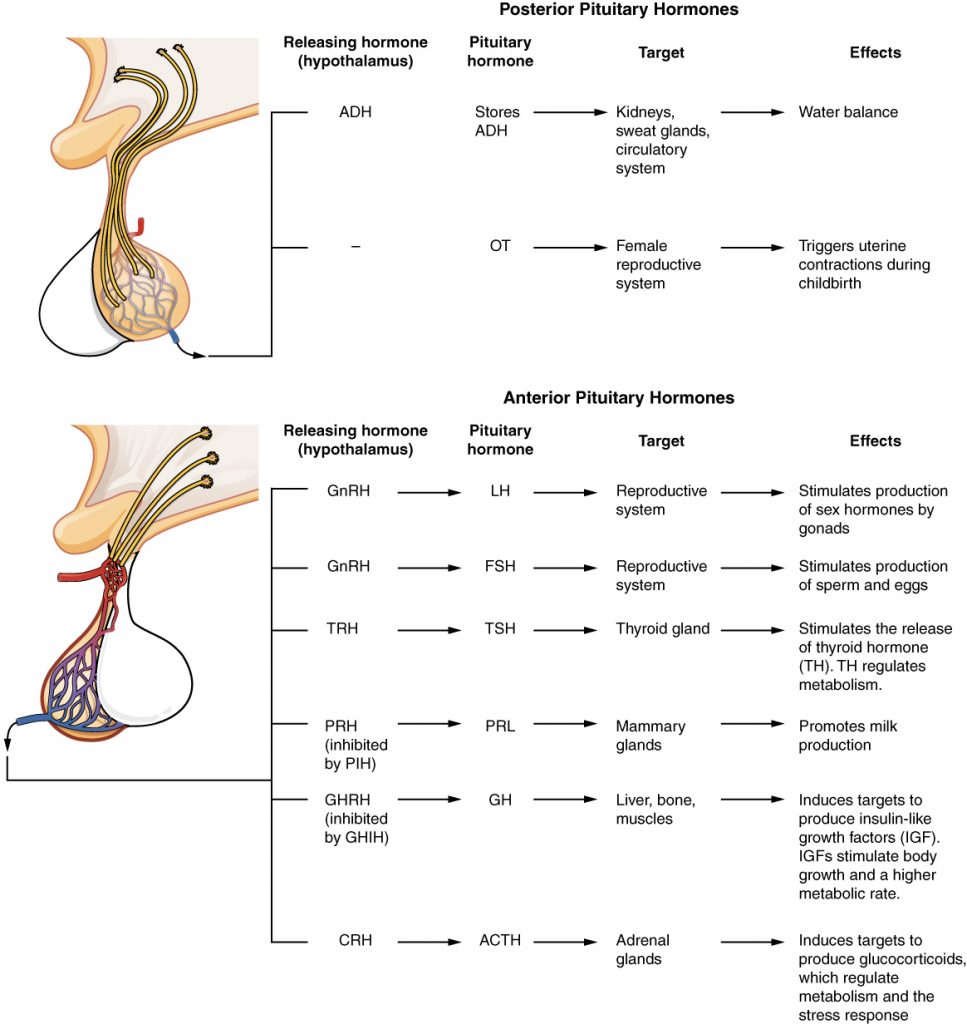
Neurohypofysen
Hypofysens baklob, neurohypofysen, utgör en del av CNS och innehåller stora terminaler till neuron som härrör från hypothalamus. Från bakloben insöndras oxytocin och vasopressin (ADH). Oxytocin verkar på glattmuskulatur i t.ex. bröstkörtlar och uterus, samt hämmar stressinducerad hormoninsöndring. Vasopressin påverkar vätskeomsättning samt insöndring av kortikotropin (ACTH).
Adenohypofysen
Vissa av hormonerna från hypofysens framlob, såsom ACTH, LH, FSH, TSH utövar sina effekter genom påverkan på andra endokrina organ, medan andra, såsom GH och prolaktin även kan verka direkt på celler i ett flertal organ i kroppen.
Framlobens hormoner kan indelas i tre huvudgrupper:
- Kortikotropiner = ACTH
- Glykoproteinhormoner = FSH, LH, TSH
- Somatomammotropiner = GH, prolaktin
Adenohypofysen står under inflytande av CNS, främst via s.k. aminer som bildas i hypothalamus. Dessa aminer benämns efter det hormon de frisätter, t.ex: CRH (corticotropin releasing hormone), GnRH (gonadotropin releasing hormone), TRH (thyrotropin releasing hormone). Frisättning av tillväxthormonet GH stimuleras av GHRH (growth hormone releasing hormone), och inhiberas av somatostatin. Insöndring av prolaktin påverkas mest av den hämmande faktorn dopamin. Flera hormoner står under kontroll genom negativ feedback från hormoner som bildas i organ styrda av hypofyshormoner (exempelvis TSH och ACTH som hämmas av tyroxin och kortisol).
Hypofystumörer
Expansiva processer i och runt sella turcica (turksadeln, där hypofysen sitter), kan ge kliniska effekter genom
- påverkan på strukturer i omgivningen med neurologiska bortfallssymptom
- sänkt hormoninsöndring från en eller flera celltyper
- ökad hormoninsöndring p.g.a. bortfall av hämmare från hypothalamus.
Symtom kan vara huvudvärk, hydrocephalus, kranialnervspåverkan, temporallobsepilepsi och rhinorré (läckage av likvor genom näsan).
Den vanligaste tumörtypen är prolaktinom och gonadotropa adenom. Mindre vanliga är GH-producerande adenom (ger gigantism eller akromegali), och ACTH-producerande adenom som leder till Cushings syndrom. Ektopisk produktion av GH och GHRH har även beskrivits vid maligna lung- och pankreastumörer.
Tillväxthormon (GH)
Många faktorer påverkar insöndringen av GH. Exempel som trauma, kirurgi, infektioner, psykisk stress, fysisk ansträngning samt snabbt insättande hypoglykemi stimulerar alla till frisättning. Några av de hämmande faktorerna är somatostatin, glukokortikoider, morfin och GH (via negativ feedback). GH-insöndring sker i normalfallet pulsatilt med topp 1-2 timmar efter att man fallit i djupsömn. Eftersom insöndringen sker pulsatilt är det viktigt att man inte baserar sin bedömning på endast ett prov. Hos barn stimulerar GH tillväxt i skelett och muskulatur, samt utövar stimulerande effekter på hjärta, pankreas, lever och njurar. Barn med bristande insöndring av GH får en ökad andel kroppsfett. GH stimulerar också proteinsyntes och fettmobilisering till lever, samt hämmar upptag av glukos i muskulatur.
Vid GH-brist föreligger i allmänhet även brist på andra hypofyshormoner, detta tillstånd kallas för panhypopituitarism (eng. pituitary gland). Exempel på sjukdomar som kan leda till nedsatt GH-insöndring är leversjukdom, njursjukdom, inflammatorisk tarmsjukdom och obehandlad celiaki. GH-brist hos barn medför hypoglykemi, nystagmus (hos nyfödda), samt kortvuxenhet. GH-brist hos vuxna ger mindre uttalade effekter såsom minskad muskelstyrka, sänkt erytropoes och ökad känslighet för insulin.
Överproduktion av GH ger gigantism (jätteväxt) hos barn och ungdomar, och akromegali (förstoring av perifert skelett, efter grekiskans akros = ytterst) hos vuxna. Vuxna får även hypermetabolism och tendens till diabetes.
Utredning av misstänkt GH-brist görs genom att mäta GH-nivån vid basala förhållanden, efter fysisk ansträngning eller efter tillförsel av stimulerande agens. Vid misstanke på överfunktion utförs upprepade provtagningar i samband med peroral glukosbelastning.
Test av GH är indicerat vid misstanke på ökad insöndring, som vid gigantism och akromegali, eller sänkt insöndring som vid kortvuxenhet eller hypoglykemi hos barn.
Prolaktin
Insöndring sker pulsatilt, toniskt (hög basalnivå) samt i sömnberoende dygnsrytm. Insöndring kan också öka inför och under psykisk och fysisk stress. Hos gravida kvinnor ökar nivån successivt för att vara 10 gånger så hög som hos icke- gravida under den sena graviditeten. Insöndring stimuleras av PRP (prolactin releasing peptide), TRH, serotonin och östrogener, medan dopamin är den i särklass viktigaste hämmaren.
De fysiologiska effekterna av prolaktin är exempelvis utveckling av bröstkörtlar och laktation. Hyperprolaktinemi ger menstruationsrubbningar hos kvinnor och minskat libido samt impotens hos män. Vanliga orsaker till hyperprolaktinemi är högt proteinintag, graviditet, amning, stress, rökning, prolaktinproducerande tumör, behandling med dopaminerga antagonister och ökad frisättning av prolaktinfrisättande faktorer (t.ex. TRH vid hypothyreos). Höga värden kan också ses vid njurinsufficiens och binjurebarkssvikt. Hos patienter med hypofystumör talar prolaktinkoncentrationer över 100μg/L för prolaktinom, om akromegali och Cushings sjukdom uteslutits.
Test av prolaktin är indicerat vid utredning av hypofystumörer, menstruationsrubbningar, hypogonadism samt vid sänkt libido, impotens och minskad kroppsbehåring (hos män). Även vid utredning av oklar huvudvärk, oklar synnedsättning, osteopeni eller oförklarlig trötthet, samt vid misstanke på multipel endokrin neoplasi (MEN).
Thyreoidea
Bildning och omsättning av sköldkörtelhormon (T3, T4) kan normalt sägas följa principen ”Av var och en efter förmåga, åt var och en efter behov” tillämpad på såväl individ- som organnivå. Den huvudsakliga produkten från tyreoidea är ett prohormon, som sedan omvandlas i lokala celler i enlighet med det lokala behovet. TRH (thyrotropin-releasing hormone) bildas i hypothalamus och når adenohypofysen som stimuleras att frisätta TSH (tyreoideastimulerande hormon) vilket stimulerar tyreoidea att frisätta tyreoideahormoner. T4 är normalt den vanligaste syntesprodukten, men andelen T3 ökar vid ökad stimulering av körteln genom TSH, TSH-receptorantikroppar och i autonoma adenom. T4 hämmar hypofysens TSH-insöndring. I plasma och i extracellulära rum transporteras thyreoideahormonerna (både T4 och T3) bundna till tyroxinbindande globulin (TBG) och transtyretin (bara T4). En mindre fraktion av de båda hormonerna är bundna med låg affinitet till albumin. Den fria fraktionen av hormonerna anses vara det mest biologiskt aktiva. Hormonerna passerar sedan cellmembranen med hjälp av transportproteiner varpå T4 omvandlas till T3 intracellulärt. Hos patienter med svår allmänsjukdom sjunker omvandlingen av T4 till T3, vilket ger temporärt förhöjd koncentration av fritt T4 och sänkning av fritt T3. Även insöndringen av TSH sjunker som följd av nedsatt TRH-insöndring, varpå även T4-koncentrationen sjunker. Patienten kan då uppvisa normal eller sänkt TSH, sänkt T3 samt förhöjd, normal eller sänkt T4 beroende på när i sjukdomsförloppet provet tas. Detta kallas ”euthyroid sick syndrome” eller ”nonthyroidal illness syndrome, NTI”.
Thyreoideastimulerande hormon (S-TSH)
TSH-insöndring kontrolleras via negativ feedback, d.v.s ökande T4-koncentration leder till minskad TSH-insöndring och vice versa. Övriga stimulerande substanser är t.ex. opioider och glukagonlik peptid (GLP-1). Inhiberande substanser är t.ex. dopamin, glukokortikoider och serotonin. Sänkning av TSH kan också ses vid akut inflammation och glukokortikoidbehandling. TSH-insöndringen uppvisar normalt en dygnsrytm med högst koncentration nattetid, varför det är viktigt att återkommande prover tas vid ungefär samma tidpunkt på dagen.
Vid primär hypotyreos minskar hämningen av TSH-syntesen vilket leder till ökad TSH-koncentration. Om tyreoidea inte kan svara med ökad hormoninsöndring på den ökade TSH-stimuleringen fortsätter hypofysen att insöndra ökade mängder TSH. Primär hypotyreos karakteriseras därför av höga koncentrationer av TSH i kombination med låg eller normal koncentration av fritt eller totalt T4 i serum.
Vid tyreotoxikos (hypertyreos) är serumkoncentration av T4 förhöjd och eventuellt även av T3. Orsaken är som regel primär tyreoideasjukdom. Genom återkopplingen hämmas därvid TSH-insöndringen, vilket leder till låg eller icke mätbar TSH-koncentration i serum. Hypertyreos sekundär till TSH-överproduktion är sällsynt, men kan ske vid TSH-bildande hypofysadenom.
Hos en patient med TSH-ökning av oklar anledning talar närvaro av TPOAk (antikroppar mot tyreoperoxidas) för att orsaken är primär tyreoideasjukdom av autoimmun genes.
Sänkt TSH kan bero på autonom överfunktion i thyreoidea, allmänsjukdom, akromegali samt behandling med kortikosteroider, betablockare och dopamin. Patienter som behandlats för tyreotoxikos kan ha kvarvarande låg TSH- koncentration under lång tid eftersom hypofysen ännu inte hunnit återfå sin normala aktivitet.
Test av TSH, tillsammans med T4/T3 är förstahandsanalyser vid misstanke om rubbning av tyreoideafunktionen.
S-T4 (tyroxin) och S-T3 (trijodtyronin)
Tyreoideahormonerna bildas genom jodering av specifika tyrosinrester i tyreoglobulin. När organismen behöver tyreoideahormon tas tyreoglobulin upp av follikelcellerna, varpå T3 och T4 frigörs genom enzymatisk spjälkning. Såväl bildning av nytt tyreoglobulin som frisättning av hormonerna från tyreoglobulin stimuleras av TSH. T3 svarar för den biologiska effekten medan T4 tjänar som en cirkulerande transportform och som buffert för T3-produktionen.
Test av T3/T4 är förstahandsvalet vid uppföljning efter insatt behandling för hypertyreos, samt är komplement till mätning av S-TSH vid fortsatt uppföljning av behandling av över- eller underfunktion i tyreoidea.
Nedan följer en lista med orsaker till förändrade värden av tyreoideahormoner:
- Förhöjt T3/T4 (fritt)
- Ökad syntes
- Graves sjukdom
- Toxiskt tyreoideaadenom
- Hypertyreos
- Multinodös toxisk struma
- Ökad thyreoglobulinnedbrytning
- Destruktionstyreoidit
- Subakut tyreoidit
- Tyst tyreoidit
- Ökat behov av thyreoideahormon
- Tyreoideahormonresistens
- Ökad syntes
- Förändrad T3/T4-kvot
- T4 > T3
- Non-tyroidal illness (t.ex. pneumoni, sepsis, hjärtinfarkt)
- T4 < T3
- Hypertyreos
- Jodbrist
- T4 > T3
- Sänkt T3/T4 (fritt)
- Underfunktion av tyreoidea
- Hypotyreos
- Underfunktion av tyreoidea
Tyroxinbindande globulin (S-TBG)
Tyreoideahormonerna transporteras i plasma bundna till plasmaproteinerna TBG och transtyretin (prealbumin), samt med låg affinitet till albumin. TBG transporterar huvuddelen av T3/T4. TBG stiger kraftigt vid östrogenpåverkan, och vid graviditet ses värden kring 4-5 gånger det normala. Tillförsel av p-piller ger mindre stegringar. Vid hypotyreos ser man vanligen något förhöjd koncentration, medan koncentrationen är normal eller sänkt vid tyreotoxikos. Ökade koncentrationer ses även vid akut virushepatit, kroniskt aktiv hepatit och primär biliär cirros. Vid levercirros är koncentrationen sänkt. Test av TBG är indicerat främst då analys av TSH och T3/T4 ger motsägelsefulla resultat.
Tyreoglobulin (S-TG)
Tyreoglobulin är som tidigare nämnt lagringsformen för tyreoideahormonerna i follikelcellslumen. Kvinnor har något högre koncentrationer än män och under graviditeten stiger koncentrationen ytterliggare. Serumkoncentrationen av tyreoglobulin är förhöjd vid en lång rad tyreoideasjukdomar inklusive former av tyreoideacancer. Uppföljning av behandling mot tyreoideacancer sker oftast med analys av tyreoglobulin i samband med TSH-stimulering.
Koncentrationen av TG stiger med ökad sköldkörtelmassa (struma, adenom), ökad funktionsgrad (Graves sjukdom) samt grad av inflammation. Ökat läckage av TG ses vid vävnadsdestruktion som vid tyreoideacancer. De allra högsta koncentrationerna ses vid follikulär tyreoideacancer, framförallt vid lung- och/eller skelettmetastaser, förutsatt att den maligna vävnaden producerar tyreoglobulin. Övergående stegring ses även vid radiojodbehandling samt efter t.ex. finnålspunktion av tyreoidea.
Sänkt TG-koncentration ses vid tyroxinbehandling (p.g.a. att TSH hämmas), samt hos patienter med endogena antikroppar mot tyreoglobulin.
Tyreoglobulinmätning kan inte användas vid differentialdiagnostik av tyreoideasjukdomar, eller för att skilja mellan benigna och maligna tumörer i tyreoidea. Test är indicerat vid uppföljning av patienter som behandlats för papillär eller follikulär tyreoideacancer. Koncentrationen bör då ställas i relation till TSH och eventuella antikroppar mot TG.
Autoantikroppar
Autoimmun tyreoideafunktionsrubbning är vanlig, med ca 2 % prevalens hos kvinnor och 0,2 % hos män. Den kan yttra sig som över- eller underfunktion, ibland växlande med tiden hos en och samma individ. De vanligaste cirkulerande autoantikropparna är de mot TSH-receptorn (TRAk), mot tyreoperoxidas (TPOAk) samt mot tyreoglobulin (TgAk). Autoantikroppar mot TSH-receptorn utövar ibland TSH-liknande effekter, och denna kroniska stimulering leder till ökad tyreoideafunktion och diffus förstoring av körteln (toxisk diffus struma, Graves sjukdom). Andra former av dessa autoantikroppar blockerar istället TSH-receptorn vilket ger hypotyreos. TPOAk förekommer främst vid Hashimoto- tyreoidit. Patienter med tyreoideacancer kan uppvisa höga koncentrationer av TgAk.
Anti-TSH-receptorantikroppar (S-TRAk)
För att avgöra om antikropparna mot TSH-receptorn är stimulerande eller blockerande krävs metoder som registrerar effekter i tyreoideaceller i odling, vid inbindning av antikroppen i fråga. Sådana metoder är tyvärr inte tillgängliga i dag, så man kan endast bestämma om antikropparna binder till TSH-receptorn så att de blockerar TSH-bindningen, och inte om de aktiverar eller blockerar receptorn. Mätning av TRAk har dock hög sensitivitet och specificitet för Graves sjukdom (upp till 99 %). Hos de med Hashimoto-tyreoidit har 10-15 % förekomst av TRAk. Hög koncentration av TRAk vid avslutad tyreostatikabehandling av tyreotoxikos innebär ökad risk för recidiv av sjukdomen. TRAk-test är indicerat vid utredning av tyreotoxikos, vid fastställande av diagnosen Graves sjukdom samt vid uppföljning av behandling för hypertyreos.
Tyreoperoxidasantikroppar (S-TPOAk)
Kan ses som indikatorer på autoimmun process, men saknar i flertalet fall patogenetisk betydelse, även som de har en viss cytotoxisk effekt på tyreoideaceller. TPOAk anses vara en riskfaktor för uppkomst av autoimmun tyreoideasjukdom, men innebär inte i sig att patienten har påvisbar rubbning av tyreoideafunktionen. Vid Hashimoto-tyreoidit är prevalensen av höjd halt TPOAk › 95 %, och vid Graves sjukdom ca 85 %. Vid substitutionsbehandling med tyroxin ses ofta sänkning av koncentrationen. I medeltal 12 % av friska individer har förhöjd koncentration av TPOAk, och frekvensen ökar med åldern samt är högre hos kvinnor än hos män. TPOAk-test är indicerat vid oklar TSH-ökning, oklar struma samt vid utredning av misstänkt autoimmun sjukdom i annat organ. Det är även indicerat vid oklar neurologisk sjukdom, med frågeställning om Hashimotoencefalopati.
Tyreoglobulinantikroppar (S-TgAk)
TgAk är påvisbara i lägre frekvens än TPOAk, men i princip gäller samma bedömning som för dessa avseende autoimmun tyreoideasjukdom. Hos patienter med behandlad tyreoideacancer talar förhöjda värden för tyreoglobulinfrisättning från abnorm tyreoideavävnad. Ca 10 % av friska individer har förhöjd koncentration av TgAk. Hos patienter med tyreoideacancer är prevalensen ungefär 20 %. Test av ThAk är indicerat framförallt vid diagnostik och uppföljning av tyreoideacancer. Stegring av TgAk-koncentrationen talar för fortsatt immunisering mot TG från malign vävnad, förutsatt att all normal tyreoideavävnad avlägsnats.
Binjurar
I binjurebarken bildas tre typer av steroidhormoner:
- Glukokortikoider, främst kortisol
- Mineralkortikoider, främst aldosteron
- Androgener, främst dehydroepiandrosteron
Kortisol
Kortisol har en rad effekter på olika organ i kroppen. Mest framträdande är effekten på kolhydratmetabolismen. Kortison, som ibland används som läkemedel, har samma effekt som kortisol eftersom det i kroppen omvandlas till kortisol. Kortisol stimulerar glukoneogenes (aminosyra → glukos), samt proteinkatabolism i muskulatur och upptag av aminosyror i levern. Övriga effekter är omfördelning av fett till bålen, hämning av tillväxthormonsekretion samt stimulering av hematopoesen. Vid svår sjukdom ökar kortisolkoncentrationerna kraftigt, detta för att öka energitillgången i vävnaderna, samt hämma den akuta inflammatoriska reaktionen. På kort sikt förbättras hemodynamiken genom ökad vätskeretention och höjd känslighet för katekolaminer (A, NA, DA). På längre sikt kan hämning av immunförsvaret bli ogynnsamt, liksom den ökade hemodynamiska belastningen.
S-Kortisol ‹ 80 nmol/L i morgonprov är starkt stöd för diagnosen binjurebarksinsufficiens (primär eller sekundär). S- Kortisol › 500 nmol/L i morgonprov är starkt stöd för att utesluta dessa diagnoser. Förhöjda värden förekommer vid Cushings syndrom, samt vid behandling med ACTH och kortison, vid graviditet och bruk av p-piller, vid diabetes mellitus samt vid stress, svåra vävnadsskador och svåra infektioner. Sänkta värden av S-kortisol förekommer vid binjurebarksinsufficiens, samt efter tillförsel av potenta syntetiska glukokortikoider såsom dexametason.
Avsaknad av dygnsvariation är ett tidigt tecken på överfunktion i binjurebarken. Utslätad dygnsvariation kan även ses vid leverskada, hjärnskada, diabetes mellitus och stress. Test av S-kortisol är indicerat vid misstanke på överfunktion i binjurebarken alternativt binjurebarksinsufficiens.
Hyperkortisolism (Mb Cushing)
Cushings sjukdom orsakas oftast av ett ACTH-producerande hypofysadenom. Patienter med Cushings sjukdom har liksom friska ett negativt feedback-förhållande mellan kortisol- och ACTH-koncentrationerna. De ACTH-producerande cellerna uppvisar dock lägre känslighet för kortisolbetingad hämning än normalt. Detta resulterar i högre kortisolpåverkan på vävnaderna än normalt. Hämningstest med dexametason (mer om det nedan), kan användas vid differentialdiagnostik av hyperkortisolism. Pseudo-Cushing-syndrom är en typ av ACTH-beroende hyperkortisolism med liknande symtom och tecken som liknar Cushings sjukdom (depression, ångest, alkoholism, polycystiskt ovariesyndrom, diabetes mellitus, obesitas). Ektopiskt* Cushing-syndrom är en följd av ektopisk bildning av ACTH. Sådan ektopisk hormonproduktion förekommer bl.a. vid bronkialcancer, medullär thyreoideacancer och karcinoidtumörer. ACTH-oberoende hyperkortisolism är en typ av Cushing-syndrom som har två skilda uppkomstmekanismer; binjurebarkstumör (oftast adenom), eller stimulering av binjurebarksvävnad av annan faktor än ACTH (t.ex. katekolaminer, ADH, LH). Observera skillnaden mellan Cushings sjukdom (ACTH från hypofysadenom), och Cushings syndrom (adenom i binjurebark eller ektopisk ACTH-produktion)!
*Ektopi är ett begrepp inom medicin som används för att beskriva processer eller vävnader som sker på fel plats i kroppen
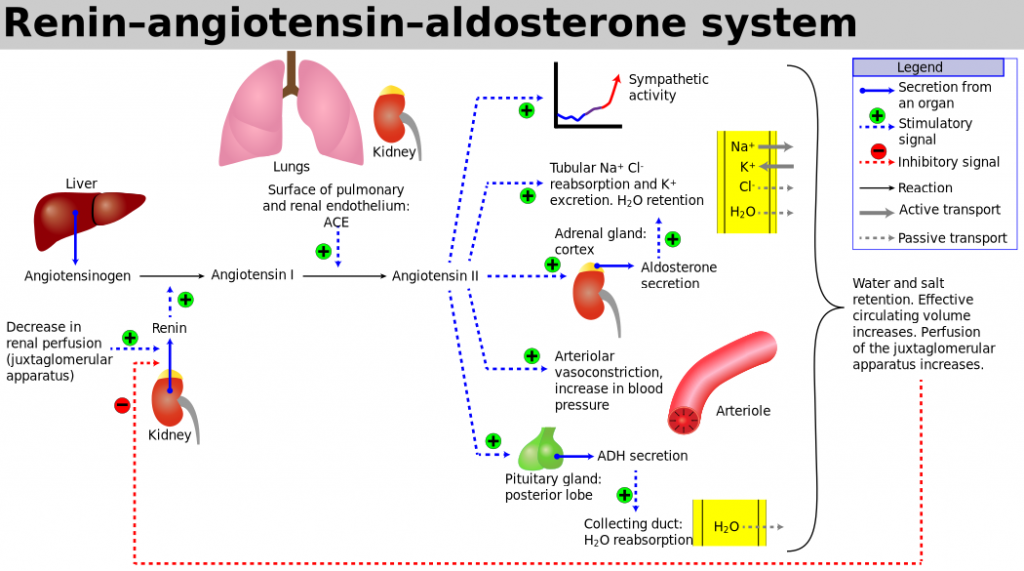
Aldosteron
Aldosteron är kroppens viktigaste mineralkortikoid. Dess viktigaste effekt är att öka återresorptionen av natriumjoner i distala tubuli, och genom detta öka den extracellulära vätskevolymen och höja blodtrycket. Brist på aldosteron, t.ex. vid Addisons sjukdom, medför stor risk för negativ natriumbalans, vilket resulterar i minskande blodvolym som kan leda till cirkulatorisk svikt och chock.
- Vid primär aldosteronism föreligger en förhöjning av aldosteroninsöndringen, där de normala kontrollmekanismerna är satta ur spel, d.v.s aldosteroninsöndringen är mer eller mindre autonom.
- Vid sekundär aldosteronism föreligger ökad aldosteroninsöndring som följd av aktivering av RAAS. En mycket ovanlig form av sekundär aldosteronism är patienter med reninproducerande tumörer.
Ett viktigt diagnoskriterium för aldosteronism är sänkt koncentration av renin i plasma i relation till aldosteronkoncentrationen (renin/aldosteron-kvot). Ofta föreligger också hypokalemi. Primär aldosteronism orsakas oftast av binjurebarksadenom eller binjurebarkshyperplasi, och mer sällan av ärftliga tillstånd som familjär hyperaldosteronism typ 1 och 2 och multipel endokrin neoplasi typ 1 (MEN1). Primär aldosteronism anses dessutom ligga bakom 10 % eller mer av fallen med hypertoni, varför utredning för aldosteronism bör göras vid oklara hypertonifall, samt vid komplikationer av hypertoni som cerebrovaskulär sjukdom (särskilt vid tidig debut). Ytterliggare indikation är oklar hypokalemi.
Renin
Regleras främst av perfusionstrycket i njurarna. Ökat perfusionstryck ger mindre reninfrisättning och vice versa. Angiotensin II hämmar reninfrisättningen, och katekolaminer/sympatikuspåslag ökar reninaktiviteten. Abnormt ökad reninfrisättning ses vid njurartärstenos. Höga reninvärden ses vid malign hypertoni samt renovaskulär hypertoni. Obehandlad binjurebarksinsufficiens (mer nedan) ger stegrat renin i plasma. Ökad halt av katekolaminer som vid feokromocytom ger också förhöjd halt. Sänkta reninvärden ses vid primärt ökad produktion av t.ex. aldosteron och i 20 % av fallen med essentiell hypertoni. Testning av renin är indicerat vid diagnostik av sekundär hypertoni i kombination med S-aldosteron, samt vid misstanke på njurartärstenos.
Binjurebarksinsufficiens
Primär binjurebarksinsufficiens innebär skada på binjurebarken (t.ex. Addisons sjukdom), medan sekundär binjurebarksinsufficiens beror på skador i hypothalamus/hypofys. Orsaker till binjurebarksskador kan vara anläggningsrubbning, enzymdefekt, autoimmunitet, infektion, blödning, läkemedelspåverkan, metastaser eller kirurgiskt ingrepp. Sekundär binjurebarksinsufficiens kan vara led i hypofysinsufficiens eller en följd av feedback-hämning.
Adrenogenitalt syndrom
Brist på enzymer som 21-hydroxylas kan ge kongenital binjurebarkshyperplasi. Detta leder till minskad kortisolproduktion, vilket i sin tur ökar produktionen av ACTH, vilket ger ökad bildning av förstadier till kortisol (t.ex progesteron), samt ökad bildning av androgener. Ökad ACTH-insöndring ger också hypertrofi av binjurebarken.
ACTH (Kortikotropin)
Referensintervall: 2-10 pmol/L. Högre värden på eftermiddagen.
Vid hypofysberoende hypersekretion av kortisol (Mb Cushing), ses i allmänhet normala till måttligt förhöjda värden. I många fall av Cushings sjukdom föreligger upphävd dygnsvariation. Vid ektopisk ACTH-produktion, t.ex. lungcancer och medullär tyreoideacancer, föreligger vanligtvis kraftigt ökad ACTH-produktion. Vid primär binjurebarksinsufficiens (Addisons), är koncentrationen i allmänhet › 100 pmol/L
Vid sekundär binjurebarksinsufficiens uppmäts normala eller låga koncentrationer av ACTH. Vid Cushings syndrom som följd av kortisolproducerande binjurebarkstumör föreligger låga koncentrationer, oftast omätbara.
Test av ACTH är indicerat vid differentialdiagnostik av Cushings syndrom, men är även av värde för att skilja mellan primär och sekundär binjurebarksinsufficiens.
Synacthentest
Synacthentest är en typ av stimuleringsundersökning av kortisolsyntesen. Man tillför den biologiskt aktiva peptiden tetrakosaktid (Synacthen – En ACTH-analog), och kontrollerar binjurens svar gällande kortisolsyntes. En normalt fungerande binjurebark ska öka kortisolsyntesen inom några minuter. En stegring av kortisolkoncentrationen ska då kunna påvisas redan 10-20 minuter efter stimuleringen. Vid sekundär binjurebarksinsufficiens, d.v.s. en följd av bristande ACTH-stimulering, har binjurebarken atrofierat. En längre tids stimulering krävs då för att binjurebarken ska återfå normal förmåga att syntetisera kortisol. Vid primär binjurebarksinsufficiens, d.v.s. otillräckligt binjurebarksparenkym, ses ingen ökad kortisolsyntes ens efter längre tids stimulering.
Dexametason-suppressionstest
Dexametason är en potent kortisolanalog som hämmar ACTH-insöndringen genom negativ-feedback. Dexametason kan därför användas för att testa hämningsbarheten av ACTH-insöndringen från hypofysen. Vid Cushings syndrom supprimeras ACTH och kortisol, och vid ACTH-oberoende tumör supprimeras endast ACTH.
Metyrapontest
Metyrapon hämmar slutsteget i biosyntesen av kortisol genom att hämma enzymet 11ß-hydroxylas. Vid normal återkoppling i hypofys-binjureaxeln resulterar metyrapontillförsel i minskad plasmanivå av kortisol i kombination med ökade plasmanivåer av ACTH. Testet görs vid misstanke på hypofysinsufficiens.
Katekolaminer
Katokolaminer är benämningen på en grupp kemiska ämnen som kommer från aminosyran tyrosin. De innehåller en amingrupp och en katokolgrupp. De tre vanligaste katokolaminerna är dopamin, noradrenalin och adrenalin. Katokolaminer är hormoner som insöndras av binjuremärgen vis psykisk stress och låga blodsockernivåer.
Tyrosin bildas av fenylalanin som vi får i oss genom kosten. Tyrosin bildar DOPA med hjälp av enzymet tyrosinhydroxylas. DOPA omvandlas sedan till dopamin, som kan omvandlas vidare i reaktionskedjan till noradrenalin. Noradrenalin är i sin tur ett förstadie till adreanalin. Alla dessa omvandlingar sker med hjälp av olika enzymer.
Feokromocytom och besläktade embryonala tumörer (neuroblastom, ganglioneurom, feokromoblastom och sympatogoniom) producerar så gott som alltid ökade mängder katekolaminer och kan därför i de flesta fall diagnosticeras genom att mäta katekolaminernas metaboliter i plasma eller urin. Bildningen och metabolismen av katekolaminerna varierar från tumör till tumör och därför även förhållandet mellan katekolaminerna och deras metaboliter i blod och urin. Vanligen utsöndras dock endast någon procent av katekolaminerna i oförändrad form från tumörerna. Den bästa uppfattningen om den totala katekolaminproduktionen i kroppen erhålls därför genom att huvudmetaboliterna (HMM, MNA, MA och HVA) kvantifieras i plasma eller urin. Mönstret av katekolaminer och deras metaboliter i plasma och urin kan ibland ge en ledtråd till var ett feokromocytom är beläget. Om det föreligger en selektivt ökad produktion av adrenalin och dess unika metabolit metoxiadrenalin (MA) är tumören sannolikt lokaliserad till binjuren, medan selektivt ökad produktion av noradrenalin och metoxinoradrenalin antyder en extrarenal tumör. Vid maligna metastaserande feokromocytom är plasmahalten av dopamin kraftigt ökad hos flertalet av patienterna till skillnad från situationen vid de vanligare benigna feokromocytomen. Hos barn med neuroblastom ses förhöjd urinutsöndring av HVA, HMM och dopamin.
Skelett
Kalcium
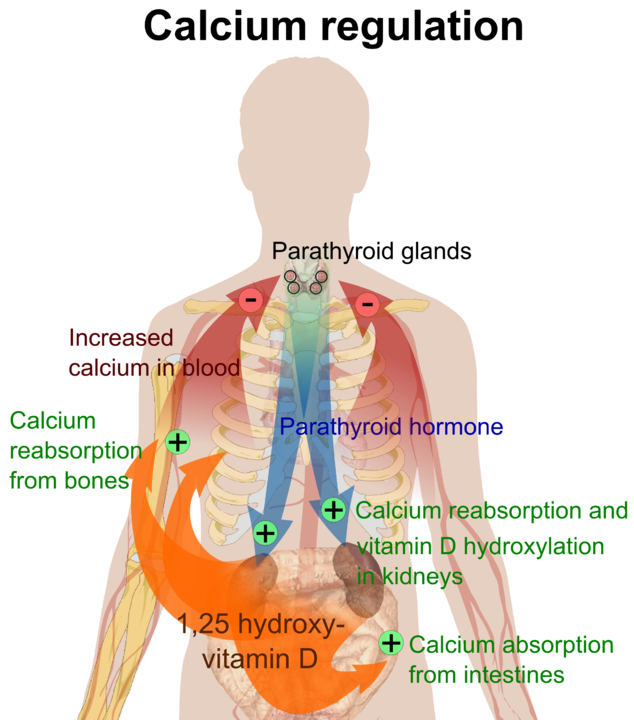
Kroppens totala kalciuminnehåll är ungefär 1 kg, varav 99 % lagras som kalciumsalter i skelettet. Ca 300 mg finns i plasma (proteinbundet, lösliga komplex och fritt joniserat). Det joniserade kalciumet är den biologiskt aktiva substansen i plasma. Den intracellulära koncentrationen är mycket lägre än den extracellulära; inströmning av kalcium aktiverar flertalet cellulära processer. Kalciumjonkoncentrationen extracellulärt är av stor vikt för flera reaktioner, såsom: enzymreaktioner, cellpermeabilitet, sekretion, muskelkontraktion, neuronaktivitet. Av denna orsak är kalciumjonkoncentrationen i plasma mycket snävt reglerat, av bland annat PTH och aktivt Vitamin D, genom sina effekter på skelett, njure och tarm.
Hypokalcemi kan bland annat orsakas av brist på vitamin D, defekt aktivering av vitamin D till 1,25-dihydroxi-vitamin D, brist på kalcium eller fosfat, brist på PTH, aktiverande mutation av kalciumreceptorn (ger minskad PTH-insöndring) och nedsatt njurfunktion. Hypoparathyreoidism leder till hypokalcemi genom minskad mobilisering av kalcium från skelettet, minskad tubulär reabsorption av kalcium och minskad Vitamin D-aktivering i njurarna. Hypokalcemin vid njursvikt har multifaktoriell bakgrund, så som rubbad Vitamin D-metabolism och fosfatretention.
Hyperkalcemi beror vanligen på ökad mobilisering av kalcium från skelettet eller, mindre vanligt, på ökad kalciumabsorption från tarmen eller ökad kalciumreabsorption i njurarna. De vanligaste orsakerna är primär hyperparatyreoidism och malignitet. Andra orsaker kan vara vitamin D- och vitamin A-intoxikation, bruk av tiaziddiuretika och litiumpreparat.
Orsaker till hypo- och hyperkalcemi, baserat på PTH-koncentration:
| Hypokalcemi | Hyperkalcemi | |
| Låg [PTH] | Autoimmun paratyreoideaskada Traumatisk skada/strålningsskada (parathyreoidea) Toxicitet (Mb Wilsons, hemokromatos) Magnesiumrubbning | Malignitet med bildning av PTHrP, eller aktivt Vit.D Primär hyperparatyreoidism med PTH-mutation Sarkoidos med bildning av aktivt Vit. D Feokromocytom Vit.D-intoxikation/Vit.A-intoxikation Tyreotoxikos Binjurebarksinsufficiens (primär/sekundär) Högt intag av kalciumpreparat |
| Låg/normal [PTH] | Aktiverande mutation av kalciumreceptorn | Tiazidbehandling (vid samtidig primär hyperparatyr.) |
| Hög [PTH] | PTH-receptordefekter Brist på Vit.D Kronisk njursvikt Sepsis (ger prokalcitonininsöndring) Magnesiumrubbning | Primär hyperparathyreoidism Inaktiverande mutation av kalciumreceptorn Autoimmun hämning av kalciumreceptorn Litiumbehandling |
Vid utredning av kalciumrubbning är det första steget att försäkra sig om att avvikande kalciumjonkoncentration verkligen föreligger, innan man väljer typ av kalciumanalys. Grundregeln säger att mängden totalkalcium i serum återspeglar kalciumjonkoncentrationen i de flesta fall där albuminkoncentrationen i plasma är normal. Hos patienter med hypoalbuminemi ger analys av totalkalcium en felaktig bild av kalciumjonkoncentrationen, varför man bör välja analys av fritt, joniserat kalcium. När patientens kalciumrubbning säkerställts är första steget att konstatera om hyperkalcemin beror på överproduktion av PTH eller via andra mekanismer. Är PTH högt, talar detta i de flesta fall för primär hyperparatyreoidism (om så är fallet, ses även lågt S-fosfat, hög kloridkoncentration samt lätt metabol acidos).
Vid sekundär hyperparatyreoidism orsakad av kronisk njursjukdom, ser man vanligen en oproportionerligt hög PTH- koncentration i förhållande till kalciumkoncentrationen, samt tecken på njurinsufficiens såsom: högt kreatinin, högt urea, hyperfosfatemi och låg koncentration av aktivt vitamin D.
Vid bedömning relateras S-Kalcium till albuminkoncentrationen. Vid tillstånd med sänkt P-Albumin (t.ex. nefrotiskt syndrom, cirros) och normal kalciumjonkoncentration ska totalkalcium alltså vara lågt utan att patienten uppvisar hypokalcemiska symtom. Vid njurinsufficiens ökar andelen komplexbundet kalcium och vid uttalad alkalos sker en ökad bindning av kalciumjoner till albumin. Hypokalcemisymtom kan då uppträda trots normal kalciumkoncentration.
Analys av kalcium är indicerat vid utredning av (bl.a):
- Skelettsjukdomar
- Endokrina sjukdomar
- Malabsorptionssjukdomar
- Sarkoidos
- Uremi
- Recidiverande njursten
- Recidiverande pankreatit
- Symtom såsom: huvudvärk, trötthet, obstipation, polyuri, tetani
Fosfat
80-85 % av kroppens fosfatdepåer ingår i skelettmineraler, och den återstående delen förekommer främst intracellulärt som organiska fosforföreningar. Av det extracellulära fosfatet förekommer ca 70 % i lipoproteinernas fosfolipider. Fosforföreningar har vitala funktioner i många biokemiska processer (t.ex. som strukturkomponent i nukleinsyror och fosfolipider och ATP, cAMP/cGMP). Fosfatbrist ger symptom från CNS (trötthet, tremor, kramper, koma), och från muskulaturen (svaghet, pareser).
Hypofosfatemi beror oftast på ökade renala förluster, som vid exempelvis tubulära defekter (Fanconi-syndrom), eller tubulär acidos. Övriga orsaker är: hyperparatyreoidism (minskad reabsorption i tubuli som resultat av PTH-effekt), malabsorptionstillstånd (brist på vitamin D → sekundär hyperparathyreoidism → PTH → minskad reabsorption). Måttlig hypofosfatemi ses även ofta hos kroniska alkoholister, samt hos personer med svåra brännskador.
Hyperfosfatemi beror vanligen på minskad renal utsöndring, som vid njurinsufficiens eller vid ökad tubulär reabsorption som vid hypoparathyreoidism. Lätta höjningar kan ses vid acidos och vid långvarig immobilisering. Vid akromegali föreligger som regel en ökning av fosfatnivån i blodet. Fosfatprov är indicerat vid alla fall av kalciumrubbning, samt i samband med oklara trötthets-, tetani- och kramptillstånd. Paratyreoideahormon (PTH) Syntetiseras i paratyreoidea, och klyvs efter insöndring av ett specifikt enzym i leverns Kupfferceller. Huvudfunktionen är att hålla koncentrationen av joniserat kalcium inom snäva gränser, genom påverkan på skelett, njurar och tarm. I skelettet ökar PTH osteoklastaktivitet vilket frigör kalcium och fosfat. I njurarna ökar PTH den tubulära reabsorptionen av kalcium och magnesium, samtidigt som det hämmar fosfatreabsorption (ökad fosfatclearance, minskad kalciumclearance). PTH stimulerar dessutom aktivering av vitamin D i njurarna. PTH verkar i tarmen genom att öka upptaget av kalcium och fosfat. PTH-insöndring styrs huvudsakligen genom negativ feedback via koncentrationen av joniserat kalcium i blodet. Detta sker via en membranbunden kalciumreceptor. Sänkta kalciumkoncentrationer ger ökad insöndring av PTH och vice versa. PTH-insöndring styrs även av fosfatkoncentrationer och mängden aktivt vitamin D. Observera att det föreligger stor intraindividuell variation vad gäller PTH-koncentration. Individer som normalt har låg PTH-nivå blir hyperkalcemiska redan vid en så måttlig ökning av PTH att mätvärdet fortfarande ligger inom referensintervallet.
Hyperparatyreoidism finns i tre olika former:
- Primär. Orsakas av adenom i paratyreoidea, som blir autonom i sin PTH-utsöndring. Ger oftast hyperkalcemi, hypofosfatemi, hyperfosfaturi och hyperkalciuri.
- Sekundär. Inträffar när körtlarna blir stimulerade till överproduktion av PTH samt hyperplasi, som en följd av långvarig hypokalcemi. Detta sker vid bl.a. njurinsufficiens och D-vitaminbrist. Kalciumkoncentrationen i serum är här oftast lätt förändrat.
- Tertiär. Extremfall av den sekundära formen. Körtlarna har som en följd av långvarig hypersekretion och hyperplasi utvecklat autonom PTH-insöndring.
Hypoparatyreoidism kan orsakas av följande exempel:
- Anläggningsrubbning av körtlarna. Orsakas av deletion av kromosom 22q11.2 (DiGeorge-syndrom, CATCH 22)
- Inaktiverande mutationer i PTH- och PTH-receptorgener
- Autoimmun påverkan (t.ex. polyglandulär endokrin sjukdom)
- Toxisk påverkan (Mb Wilsons, hemokromatos)
- Magnesiumrubbning
Mätning av PTH är indicerat vid alla utredningar av rubbningar i kalcium-, fosfat- och magnesiumhomeostasen. PTH-mätning görs även under uppföljningen av patienter som opererats för primär hyperparathyreoidism.
PTHrP (PTH-relaterad peptid)
PTHrP ger humoral hyperkalcemi vid malignitet och bidrar till uppkomsten av cancerkakexi. Indikation för att analysera PTHrP är uttalad hyperkalcemi utan PTH-ökning eller påvisat skelettangagemang,
Vitamin D
Vitamin D är en viktig regulator av kalciumhomeostasen genom sin påverkan på tarm, njurar, paratyreoidea och ben. Brist på vitamin D leder till defekt mineralisering i benvävnaden, vilket kan ge rakit hos barn och osteomalaci hos vuxna. Detta beror på att brist på vitamin D leder till otillräckliga koncentrationer av kalcium och fosfat i extracellulärvätskan, vilket stör inlagrings- och mobiliseringsprocesserna i benvävnaden. Vitamin D har även vissa effekter på cellproliferation, celldifferentiering, samt på immunförsvaret och det neuromuskulära systemet.
Vitamin D från kosten och från syntes i huden genom solexponering omvandlas i levern genom hydroxylering till kalcidiol (25-OH-Vit D). Det omvandlas i sin tur genom ny hydroxylering i njurarna till det metaboliskt aktiva kalcitriol (1, 25(OH)2 vitamin D). Alla dessa former av vitamin D transporteras i blodet bundna till vitamin D-binding protein (DBP). Som alla steriodhormoner påverkar kalcitriol sedan nukleära receptorer, och det är så vitamin D utövar sin effekt.
Vitamin D-status bestäms genom mätning av kalcidiol (25-OH-vit D) i serum.
Calcitonin
Bildas i C-celler i tyreoidea. En ökning av kalciumjonkoncentrationen leder till calcitoninfrisättning, vilket inom några minuter sänker kalcium- och fosfatkoncentrationerna i plasma genom hämning av osteoklastaktivitet samt ökad utsöndring av jonerna i urinen. Det är oklart om kalcitonin spelar någon roll för kalciumomsättningen under normala förhållanden. Däremot kan farmakologiska doser av calcitonin ha påtagliga effekter vid hyperkalcemi genom hämning av bennedbrytningen.
Gonader
Könshormonerna östrogener och androgener bildas främst i gonaderna, d.v.s. ovarier hos kvinnor och testiklar hos män. Androgener bildas också i binjurarna. Könshormoner kan också bildas i tumörvävnader (t.ex. bildning av testosteron i prostatacancer). Gonaderna står under inflytande av de två gonadotropinerna FSH och LH, som bildas i hypofysens framlob. Under graviditeten påverkas dessutom gonaderna av ett gonatotropin från placenta, nämligen hCG (humant koriongonadotropin – som även mäts vid graviditetstest). Även hypofysens prolaktin påverkar gonaderna, där hyperprolaktinemi leder till oligomenorré eller amenorré (mycket/lite mens). Gonadotropinerna står i sin tur under inflytande av GnRH (gonadotropin releasing hormone), som bildas i hypothalamus.
Hos den fertila, icke-gravida kvinnan domineras könshormonerna från ovariet av östradiol och progesteron. Under graviditeten dominerar östriol. Hos mannen är testosteron det dominerande könshormonet. Gonaderna bildar även övriga peptider, som t.ex. AMH (anti-müllerskt hormon). S-AMH undersöks för att få information om det ovariella reserven, t.ex. inför in vitro- fertilisering. Efter klimakteriet minskar således nivåerna. Hos kvinnor stimulerar FSH granulosacellerna i ovariefolliklarna till proliferation och östradiolsyntes. LH inducerar ovulation, underhåller corpus luteum samt stimulerar dess produktion av progesteron. Hos män stimulerar FSH spermatogenesen, medan LH stimulerar testosteronbildningen i Leydigcellerna.
Analys av gonadotropiner (LH/FSH)
Vid primär gonadinsufficiens föreligger hög koncentration av gonadotropinerna (främst FSH). Sekundär gonadinsufficiens är däremot en följd av nedsatt gonadotropininsöndring. Patienter med hemokromatos kan uppvisa gonadotropinbrist sekundär till järninlagring i de gonadotropa cellerna. Patienter med polycystiskt ovariesyndrom har vanligen normalt FSH, men lätt förhöjt LH. Hormonproducerande tumörer i ovarier eller testiklar kan orsaka mycket höga nivåer av LH. Hög FSH-koncentration hos patienter med primär amenorré kan vara ett uttryck för gonaddysgenesi (utvecklingsrubbning), ett potentiellt mycket allvarligt tillstånd. Samtidiga mätningar av båda gonadotropinerna kan vara indicerat vid oklara fall av infertilitet hos män och kvinnor. Vid klimakteriet ökar nivåerna av FSH och LH.
Inhibin B
Inhibin hämmar FSH-insöndringen. Flera typer av ovarialtumörer insöndrar bl.a. Inhibin B, vilket resulterar i selektivt låg FSH-koncentration. Hos män kan inhibin mätas för att diagnosticera infertilitet. Används också som biomarkör för ovarialtumörer.
Progesteron
Progesteron stimulerar tillsammans med östradiol endometriet till att bli mottagligt för implantation av det befruktade ägget. Progesteronkoncentrationen i blodet regleras bl.a. av LH (stimulerar insöndring), samtidigt som hög progesteronhalt hämmar frisättning av gonadotropinerna. P-piller med gestagener använder denna hämning. Subnormala värden förekommer vid anovulatoriska cykler och vid bristande corpus luteum-funktion. Förhöjda värden förekommer vid ofullständig placentaavgång efter graviditet, samt vid mola hydatiosa (trofoblasttumör) och koriocarcinom. Test är indicerat vid utredning av infertilitet och menstruationsrubbningar. Vid klimakteriet minskar nivåerna av progesteron.
Östradiol/Östron
Dessa är de dominerande östrogenen hos den fertila icke-gravida kvinnan. De bildas under inflytande av gonadotropinerna. Låga östradiolhalter ses vid amenorré orsakad av hypotalamisk, hypofysär eller ovariell insufficiens. Höga nivåer ses hos kvinnor vid t.ex. östrogenproducerande tumörer, samt hos män vid t.ex svåra leverskador.
Östron bildas i ovarierna samt från androstendion, och metaboliseras i levern för att sedan utsöndras med gallan. Testning av östron är indicerat vid postmenopausala blödningar samt eventuellt vid mammarcancer. Vid klimakteriet minskar nivåerna av östradiol.
Testosteron
Testosteron bildas främst i testiklarna hos män och stimuleras av LH, samt som biprodukt vid syntes av kortikoider och östrogener hos kvinnor. I plasma binds ca hälften av testosteron till SHBG (könshormonbindande globulin), och resterande med låg affinitet till albumin. Nedbrytningen av testosteron äger framför allt rum i levern men ca 20 % bryts ned i huden och i prostata. Tillstånd med ökad halt av SHBG är förutom graviditet; levercirros, hyperthyreos, hypogonadism och östrogenbehandling. Sänkt halt av SHBG ses vid hypothyreos, fetma och vid behandling med androgener och glukokortikoider.
Mätning av S-SHBG är indicerat vid misstanke på viriliserande tumörer, polycystiskt ovariesyndrom, eller kongenital binjurebarkshyperplasi hos kvinnor. Hos män är det indicerat vid utredning av impotens och vid misstanke på hypogonadism.
Alkoholmarkörer
De tillgängliga alkoholmarkörernas specificitet varierar sinsemellan och mellan olika patientpopulationer. Exempelvis är specificitet för GT (glutamyltransferas) god i en väsentligen frisk primärvårdspopulation medan den är låg för sjukhusvårdade patienter. Val av alkoholmarkörer beror också på vilka patientgrupper man önskar diagnosticera. De flesta markörer är användbara för att diagnosticera alkoholberoende patienter med långvarig konsumtion, men de har betydligt lägre sensitivitet när det gäller att diagnosticera högkonsumenter i riskzonen. Ytterliggare ett problem är att alkoholmarkörerna utvecklats för att detektera män med alkoholmissbruk, och funkar således sämre vid diagnostik av kvinnliga alkoholmissbrukare.
Kolhydratfattigt transferrin (CDT)
En specifik markör för hög konsumtion av alkohol. Mer än 90 % av de patienter som har förhöjda värden är alkoholmissbrukare. Sensitiviteten är dock 25-75 % beroende på population och frågeställning. CDT stiger först efter ett par veckors missbruk av mer än 60g etanol dagligen (motsvarar en flaska vin/tre starköl/20 cl starksprit). Vid sådan konsumtion är sensitiviteten ca 50 %. Först vid missbruk av ca 100g etanol per dag stiger sensitiviteten till runt 90 %.
Lätt förhöjda CDT-värden kan förekomma vid primär biliär cirros. Genetiska varianter av transferrin kan ge falskt negativa eller falskt positiva resultat.
Glutamyltransferas (GT)
Måttlig sensitivitet (25-75 %). Påverkas av många andra faktorer (diabetes, övervikt, antidepressiva) än alkohol —› låg specificitet. För att uppnå förhöjt GT krävs långvarig och hög alkoholkonsumtion snarlik den som orsakar ökning av CDT.
Mean corpuscular volume (MCV)
Makrocytiska erytrocyter talar för missbruk av alkohol (spec. i primärvården). MCV har visats sig ha bättre diagnostisk potential hos kvinnor än män.
Fosfatidyletanol (PEth)
Lipid som normalt inte förekommer i kroppen, och endast bildas vid närvaro av etanol. Detekterbara nivåer av PEth uppkommer efter upprepade och måttliga intag (› 40 g etanol per dag). Halveringstiden är ca 4 dagar och förekomsten kan detekteras upp till fyra veckor efter upphörd konsumtion. Eftersom PEth endast bildas i närvaro av etanol och inte förekommer hos nykterister är sensitivitet och specificitet 99 respektive 100 %. Observera dock att den vetenskapliga dokumentationen är begränsad rörande denna markör.
Tumörmarkörer
Författare: Emma Widén (VT15). Modifierad av Elliot Soomro (VT21).
Tumörmarkörer är ämnen i kroppen (enzymer, proteiner eller gener) som är mer eller mindre specifika för olika typer av cancer. Beroende på hur känsliga de är kan de användas för screening, diagnos, prognos, behandlingseffekt och/eller för att undersöka recidiv.
Carcinoembryonalt antigen (CEA)
CEA är ett glykoprotein som finns i kolonslemhinnan och tillhör gruppen onkofetala antigen (liksom AFP). Det förekommer i ökad halt vid kolorektalcancer, lungcancer, pankreascancer samt bröstcancer. Kraftigt förhöjda halter förekommer framförallt vid metastasering eller primärtumör i GI. Preoperativ CEA-nivå har prognostisk betydelse vid kolorektalcancer. Testet är indicerat vid uppföljning av behandlingseffekt vid kolorektal-, pankreas- och lungcancer.
Cancerassocierat antigen 19-9 (CA19-9)
Ett glykoprotein, ett mucin som produceras i många celltyper i GI-kanalen, även normala celler. Det är förhöjt hos 80-95 % av patienter med pancreascancer, och kan användas för att följa sjukdomsförlopp och behandlingseffekt. Det är även den bästa markören för gallgångscancer och är förhöjt hos 75 % av patienterna. Testet är fr a indicerat vid terapiuppföljning och förloppkontroll av pancreascancer- och gallgångscancerpatienter. Det kan också användas tillsammans med CEA och TPA vid kolorektalcancer.
Cytokeratin
Finns i cytoskelettet hos olika typer av epitel. Den mest använda formen är TPA (tissue-polypeptide-antigen), och andra former är CYFRA21 och TPS. TPA och CYFRA mäter cytokeratin 19 som är förhöjt vid lungcancer. TPA mäter cytokeratin 18, som är den viktigaste cytokeratinen att mäta vid bröstcancer. Cytokeratiner är oftast ett komplement till andra tumörmarkörer, och är då mest lämpad för att följa förlopp och terapieffekter – fr a vid kolorektal-, bröst- och lungcancer.
Cancerassocierat antigen 15-5 (CA15-3)
Också denna CA är ett mucin som finns i alveoli och bröstgångar. Det kan användas för uppföljning av behandling samt för att upptäcka recidiv hos bröstcancerpatienter. CA15-3, TPA/TPS och CEA de mest använda markörerna vid bröstcancer.
Cancerassocierat antigen 125 (CA125)
Mucinliknande glykoprotein som normalt produceras i celomiskt epitel (pleura, perikard, peritoneum). CA125 är förhöjd i serum hos många icke-mucinösa ovarialcancrar. Markören är av värde att följa behandlingseffekt och upptäcka recidiv långt innan kliniska tecken föreligger.
Humant epididymisprotein 4 (HE4)
Glykosylerat protein som normalt uttrycks i många olika vävnader. Det är en nyintroducerad tumörmarkör för ovarialcancer, och uttrycks fr a i serösa och endrometroida tumörer. Även klarcellstumörer uttrycker HE4 ibland, men mucinösa gör det aldrig. HE4 har högre sensitivitet än CA125 i tidigt stadie av sjukdomen. Det används tillsammans med CA125 för att bedöma resistens i lilla bäckenet hos patienter, och kombinerat har de högre sensitivitet för cancer.
Squamous cell carcinoma antigen (SCCA)
Finns i skivepitelcellers cytoplasma och kan påvisas i serum hos patienter med skivepitelcancer, och används fr a för att följa patienter med skivepitelcancer i cervix, matstrupe och lungor. Kan också användas för att avgöra prognos.
Humant koriongonadotropin (hCG)
När det kommer till cancer används hCG för testikelcancer tillsammans med ∂-fetoprotein. Vid choriocarcinom är nivåerna av hCG höjda hos nästan alla, eftersom tumörerna innehåller syncytietrofoblaster som producerar hCG. Det kan också användas tillsammans med AFP vid embryonalt carcinom, och även vid mola hyatidosa. Det kan användas diagnostiskt, eller för att följa behandlingseffekt, eller för att upptäcka recidiv.
∂-fetoprotein (AFP)
AFP är ett onkofetalt protein som förekommer främst under fosterlivet, i fostrets lever, GI och gulesäck. Innan födsel avtar nivåerna. Primär levercancer och embyronalt carcinom kan ge höga nivåer av AFP i plasma, och AFP är faktiskt den bästa markören för primär levercellscancer. Det kan således vara förhöjt vid levercancer, testikelcancer (används då tillsammans med hCG och LD). Det kan användas för att upptäcka tumörerna, samt för att följa upp behandling.
Prostata-specifikt antigen (PSA)
PSA är ett serinproteas som bildas i prostatas körtelepitel och utsöndras i höga halter till prostatasekretet. Testosteron och DHT stimulerar prostata till sekretion av PSA. Det produceras även i bröstkörtelepitelet, men i små mängder. Först bildas en zymogen till PSA, alltså en prekursor. Funktionen i sädesvätskan är att likvifiera koaglet av sädesvätska som först bildas efter ejakulation, genom att PSA spjälkar gelproteiner som bildas i sädesblåsan. Ett ökat läckage av PSA ut i plasman ses vid skada på prostata, som vid prostatit, prostatacancer eller BPH mm. I blodet förekommer det främst i komplex med ∂1-antikymotrypsin eller ∂2-makroglobulin. Tillgängliga metoder mäter bara PSA i komplex med ∂1- antikymotrypsin (som utgör 80-85 % av totalt PSA). PSA kan även förekomma fritt i blodet, men har då kort halveringstid, men upptäcks också med mätningsmetoden som används. Mätning av endast fritt PSA har visat sig vara bra vid uppföljning av prostatacancerpatienter, som har en lägre andel fritt PSA i plasma än normalt. Vid BPH sjunker andelen komplexbunden PSA till 70 %, och andelen fritt ökar alltså.
Mätningsmetoden går ut på immunokemisk teknik med monoklonala antikroppar som mäter både fritt PSA och komplexbundet till ∂1-antikymotrypsin.
PSA-höjning i plasma har hög känslighet för prostatacancer men cancern kan förekomma utan höjning också. Vid måttlig höjning är BPH den vanligaste orsaken (3-10mikrogram/liter), bara 20 % som ligger i det intervallet har cancer. Har man över 10 mikroliter har mer än 50 % cancer.
PSA är framför allt bra för uppföljning efter strålning eller radikal borttagning, ökning tyder då på recidiv. Vid kemisk kastrering (testosteronhämmare) faller PSA, och korrelerar bra med klinisk respons på hormonbehandlingen också.
Man har insett att med screening med PSA kan diagnos komma 5-13 år tidigare, men 80 % av de tumörerna kommer aldrig medföra ökad dödlighet.
Neuronspecifikt enolas (NSE)
Ett enzym som normalt finns i nervceller och i vissa endokrina celler. Tumörer med neuroendokrin differentiering, som neuroblastom och småcellig lungcancer samt seminom kan frisätta NSE till blodet. Förhöjda koncentrationer kan också förekomma vid karcinoid, tyreoideacancer mm. NSE används för kontroll av förlopp och behandling av patienter med kända neuroendokrina tumörer och SCLC. Det är också av intresse att följa vid vissa seminom.
Progastrin-releasing peptide (ProGRP)
ProGRP är ett prohormon till GRP som kan användas för att monitorera förlopp av SCLC (tillsammans med NSE). Det har en mycket högre högre sensitivitet för att skilja SCLC från icke-SCLC och friska än NSE. Det har alltså högt negativt prediktivt värde för SCLC.
Testet är således indicerat vid uppföljning av patienter med SCLC och ibland för att differentiera mellan SCLC och icke- SCLC när biopsi innebär för stor risk.
S100-ß
S100-ß är en grupp intracellulära calciumbindande proteiner, och kommer från celler med ektodermalt ursprung. Proteinet deltar i cellcykeln, differentiering, tillväxt och mycket annat. Det är förhöjt vid primära hjärntumörer samt vid metastasering till hjärnan, men ger ingen vägledning om vilken tumörform det handlar om. Serumkoncentrationen korrelerar också till tumörstadium och prognos vid malignt melanom, men i diagnostiken används bara undersökning av hud och histopatologi. Testet är därför indicerat för uppföljning av patienter med hjärntumörer och maligna melanom, samt vid trauma mot huvudet och stroke.
Kromogranin A (CgA)
Kromogranin A förekommer i hög koncentration i sekretionsgranulas i neuroendokrina celler. Kliniskt används den som markör för tumörer med neuroendokrin differentiering. Vid stora tumörer är sensitiviteten nära 100 %, dvs. att man hittar alla sjuka med testet. Det kan användas för att påvisa och för behandlingsuppföljning för tumörer som hypofystumör, medullär tyreoideacancer, paratyreoideacancer, karcinoid, gastrinom, neuroblastom och GI-endokrina tumörer.
Kalcitonin (CT)
CT bildas i parafollikulära celler som kallas C-celler i tyreoidea. De är en reglerande del i kalciumhomeostasen. Hyperkalcemi stimulerar C-cellerna till att utsöndra CT, vilket ger en snabb sänkning av serumkalcium fr a genom att man hämmar benresorbtionen i skelettet. Man tror att det finns för att balansera PTHs funktion. Vid medullär tyreoideacancer har CT en hög sensitivitet och kan användas för att screena släktingar till de som drabbas. Nivån i serum korrelerar med tumörmassa. CT är indicerat vid misstanke om medullär tyreoideacancer, när finnålsbiopsi inte ger konklusion. Vid feokromocytom är det också indicerat, och för båda tumörerna kan man följa förlopp och behandlingssvar. C-cellerna producerar också ofta CEA, och därför är också den då förhöjd tillsammans med CT i serum. CEA har dock inte alls lika hög specificitet som CT.
Provokationsundersökningar. Vid begränsad tumörcellsmassa, som vid tidig medullär tyreoideacancer, kan den basala CT-nivån i serum vara normal. Detta falskt negativa resultat som man då får när man testar för CT kan kringgås genom att man stimulerar tumörcellerna till frisättning av CT genom att inducera en akut hyperkalcemi. Redan vid C- cellshyperplasi kan man då se kraftiga stigningar.
Thyreoglobulin (TG)
Proteinet bildas i tyreoideacellerna och deponeras i folliklarna. TG är matrix för hormonsyntesen som en intrafollikulär depå för T4/T3. Normalt finns små mängder TG i cirkulationen. Koncentrationen höjs vid flera tyreoideasjukdomar, inklusive tyreoideacancer. Testet är fr a indicerat vid uppföljning av patienter som behandlas för tyreoideacancer.
Lysozym
Enzym som finns i granulocyter och frisätts vid degranulering. Det förekommer även i det sekret som skyddar slemhinnor. Vid normal njurfunktion återspeglar serumlysozym antalet lysozymproducerande celler och deras benägenhet att frisätta enzymet. Ökad serumkoncentration ses vid ökad omsättning av monocyter och granulocyter, som vid KLL och poycytemia vera. Vid myelocytleukemi och monocytleukemi är nivåerna i serum och urin kraftigt höjda, men vid lymfatiskt leukemi är de inte höjda. Testet är indicerat vid utredning av monocyt/makrofag-aktivitet, och är alltså av intresse vid kronisk bronkit, sarkoidos, HIV, vissa cancerformer och TBC, samt vid akuta och kroniska myeloiska leukemier.
Tymidinkinas (TK)
Ett enzym som medverkar i DNA-syntesen. När celler går i nekros frigörs bl a TK till cirkulationen, och detta sker oftare i maligna celler än i normala, och därför kan TK vara förhöjt vid maligna sjukdomar. Men det är alltså inte en tumörspecifik tumör, men visar att det föreligger en ökad cellproliferation. Det används fr a vid hematologiska maligniteter, som vid non-Hodgkins och leukemier, för att följa förlopp samt terapieffekt.
Monoklonala antikroppar
Monoklonal ökning av immunoglobuliner syftar till en ökning av en enda cellklon, och vid elektrofores bildar denna klons M-komponent ett skarpt avgränsat band. Det är ett vanligt fynd vid meylom (multipelt myelom, myelomatos). Ofta förekommer samtidigt:
- Sänkt halt av de andra Ig-typerna, inklusive andra kloner av samma Ig-klass.
- Ökad förekomst av fria monoklonala immunoglobulinkedjor i plasma och i urinen (=Bence Jones proteinuri)
- Ökad koncentration av ß2-mikroglobulin i plasma
- Hypercalcemi
- Hypoalbuminemi
- Anemi
- Ökad andel plasmaceller i benmärg
Agarosgelelektrofores för att påvisa M-komponent är indicerat vid misstänkt myelomatos/makroglobulinemi, t.ex. vid hög SR, anemi, oprovocerad fraktur, hypercalcemi, infektionsbenägenhet eller förekomst av Bence Jones-proteinuri. Halten ska alltid bestämmas för att få ett mått på hur stor tumörcellsklonen är.

Hej!
vet ni om det finns en andra del till sammanfattningen? det som vi har haft nu i början ser inte jag står med här.. eller? SUPER schysst att ni la upp den här!!
Tack till Kristoffer och Emma! Detta borde vara hela sammanfattningen. Vad är det som du tycker saknas?:)
Jag tänkte på typ allergi / bröstcancer ex. phadiatop, jag tänkte på veckorna som har varit hittills ex. pbl 1-8. Men jag kanske bara kollar fel 🙂
Ah, ok. Nä tyvärr finns det inte med i denna sammanfattning.
Om man inte har läst klinisk kemi och inser det nu (PBL 11) – är det kört? Har ni några tips på hur man kan ta igen det nu?
Hej!
Det är absolut inte kört. Jag tycker att denna sammanfattningen räcker samt om man hängt med på “klinisk kemi” övningarna. Kolla på lite gamla tentafrågor och läs lite i denna sammanfattning kopplat till de nästkommande PBL-fallen så tror jag att du fixar det galant. Lycka till!